(17分)铁及其化合物应用广泛。
(1)三氯化铁是一种水处理剂,工业制备无水三氯化铁固体的部分流程如下图:
①检验副产品中含有X时,选用的试剂是 (填下列各项中序号)。
a.NaOH溶液 b.KSCN溶液 c.酸性KMnO4溶液 d.铁粉
②在吸收塔中,生成副产品FeCl。的离子方程式为
(2)高铁酸钾(K2FeO4)也是一种优良的水处理剂,工业上,可用铁作阳极,电解KOH溶液制备高铁酸钾。电解过程中,阳极的电极反应式为 ;电解一段时间后,若阳极质量减少28 g,则在此过程中,阴极析出的气体在标准状况下的体积为 L。
(3)硫化亚铁常用于工业废水的处理。
①你认为,能否用硫化亚铁处理含Cd2+的工业废水? (填“能”或“否”)。请根据沉淀溶解平衡的原理解释你的观点(用必要的文字和离子方程式说明):
(已知:25℃时,溶度积常数Ksp(FeS)=6.3×10-18、Ksp(CdS)=3.6×10-29)
②工业上处理含Cd2+废水还可以采用加碳酸钠的方法,反应如下:2Cd2++2CO32-+H2O===Cd2(OH)2CO3 +A。则A的化学式为 。
+A。则A的化学式为 。
观察下列A、B、C、D、E五种粒子(原子或离子)的结构示意图,回答有关问题。
(1)上述离子中属于金属元素的是________(填元素符号),与非金属原子相对应的离子的结构示意图是______。
(2)电子层结构相同的是__________(填序号,下同),性质最稳定的是________,最容易失去电子的是________,最容易得到电子的是______________。
(3)可直接相互结合形成的化合物的化学式是__________,可经过得失电子后再相互结合形成的化合物的化学式是_____________。
“探险队员”——盐酸,不小心走进了化学迷宫,不知怎样走出来,因为迷宫有许多“吃人的野兽”(即能与盐酸反应的物质或者是水溶液),盐酸必须避开它们,否则就无法通过。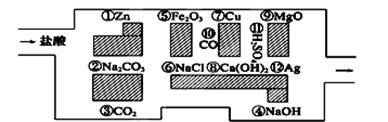
(1)请你帮助它走出迷宫(请用图中物质前的序号连接起来表示所走的路线)____________。
(2)在能“吃掉”盐酸的化学反应中,其中能“吃掉”盐酸的盐是_______________(填化学式),写出该反应的化学方程式_______________________________________________。
(3)如果将盐酸换成氧气,它能沿着盐酸走出的路线“走出”这个迷宫吗?为什么?
________________________________________________________________________。
现有下列物质:①氯酸钾 ②硫酸铜 ③二氧化硅 ④镁 ⑤氧气 ⑥氢氧化钠
⑦硫酸 ⑧甲烷请将上述物质按下列要求分类,并将其序号填入空白处:
(1)按组成分类,属于有机物的是(填序号)。
(2)属于电解质的有(填序号),依次写出其电离方程式:
(3)从上述物质中选出1种或2种为反应物,按下列反应类型各写1个化学方程式:
①化合反应 ;
②分解反应;
③置换反应 ;
④复分解反应。
(10分)
(1)6.02×1023个CO2与molH2质量相等,与gSO2含有的原子个数相等;
(2)含0.4molCl的氯化镁是mol,质量是g,它跟g氯化钠含有相同数目的Cl;
(3)4molNa2CO3与molNa2SO4所含氧原子数相等;
(4)8g的甲烷是mol,约含个甲烷分子,g碳元素,mol氢原子。
用一种试剂除去下列各物质中的杂质(括号内的物质)。写出所用试剂及离子方程式。
(1)BaCl2(HCl):试剂,离子方程式。
(2)O2(CO2):试剂,离子方程式。
(3)SO42-(CO32-):试剂,离子方程式。
(4)Cu粉(Al粉):试剂,离子方程式。