观察下列A、B、C、D、E五种粒子(原子或离子)的结构示意图,回答有关问题。
(1)上述离子中属于金属元素的是________(填元素符号),与非金属原子相对应的离子的结构示意图是______。
(2)电子层结构相同的是__________(填序号,下同),性质最稳定的是________,最容易失去电子的是________,最容易得到电子的是______________。
(3)可直接相互结合形成的化合物的化学式是__________,可经过得失电子后再相互结合形成的化合物的化学式是_____________。
(6分,每空1分)已知A、B、C、D均为短周期元素,它们的原子序数依次递增。 A是最外层为一个电子的非金属元素,C 原子的最外层电子数是次外层的3倍; C和D可形成两种固态化合物,其中一种为淡黄色固体;B和C可形成多种气态化合物。A、B、C三种元素可以形成离子晶体,该晶体中各元素原子的物质的量之比为A:B:C=4:2:3。
请回答下列问题:
(1)写出B的原子结构示意图,写出C和D形成的淡黄色固体化合物的电子式。
(2)元素原子的物质的量之比为A:B:C="4:2:3" 的晶体名称为。
(3)请写出与A2C和BA3分子中电子数相同,且仍由A、B、C元素中任意两种元素组成的微粒的符号(举两例)、。
(4)写出由B、C元素组成且元素原子质量比为B:C=7:12的化合物的化学式。
现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如下图所示(图中有些反应的生成物和反应的条件没有标出)。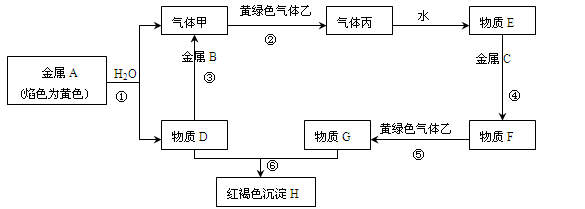
请回答下列问题:
(1)写出下列物质的化学式:B、丙、乙。
(2)写出下列反应的化学方程式:
反应①;
反应⑤;
反应⑥。
蒽( )反应生成化合物X(立体对称图形),如下图所示:
)反应生成化合物X(立体对称图形),如下图所示: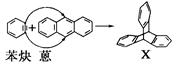
(1)蒽与X都属于________(填选项,下同)。
A.环烃B.烷烃C.芳香烃
(2)苯炔的分子式为________,苯炔不具有的性质是________。
A.能溶于水B.能发生氧化反应
C.能发生加成反应D.常温常压下为气体
(3)1866年凯库勒提出了苯的单、双键交替的正六边形平面结构,解释了苯的部分性质,但还有一些问题尚未解决,它不能解释下列事实。
A.苯不能使溴水褪色B.苯能与H2发生加成反应
C.溴苯没有同分异构体D.邻二溴苯只有一种
现代化学认为苯分子碳碳之间的键是。
(4)下列属于苯的同系物的是________。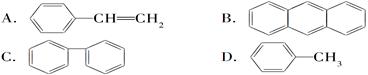
(5)能发生加成反应,也能发生取代反应,同时能使溴水因反应而褪色,也能使酸性高锰酸钾溶液褪色的是________。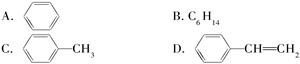
它是生产某塑料的单体,写出合成该塑料的化学方程式:__________________________。
有甲、乙两种物质: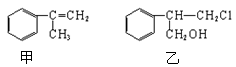
(1)乙中含有的官能团的名称为_______________。
(2)写出同时满足下列条件的甲的一种同分异构体的结构简式:。
Ⅰ.分子中除苯环外,无其他环状结构;
Ⅱ.苯环上只有一个取代基;Ⅲ.存在顺反异构
(3)写出甲与H2完全加成的化学方程式。
(4)由甲转化为乙需经下列过程(已略去各步反应的无关产物):
其中反应II的反应条件____________,
反应III的化学方程式为,反应类型____________。
Ⅰ.现有CH4、C2H4、苯三种有机化合物:
(1)等质量的以上三种物质完全燃烧时耗去O2的量最多的是_______。
(2)等物质的量以上三种物质完全燃烧时耗去O2的量最多的是________。
(3)等质量的以上三种物质完全燃烧时生成CO2的量最多的是________。
Ⅱ.按要求书写:
(1)羟基的电子式;
(2)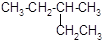 的系统命名为。
的系统命名为。
(3)相对分子质量为72且沸点最低的烷烃的结构简式;
(4)某芳香烃的相对分子质量为102,若该分子内所有原子均在同一平面内,则其结构简式为。