I.磷、硫元素的单质和化合物应用广泛。
(1)磷元素的原子结构示意图是
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500°C生成白磷,反应为:
每生成 1时,就有
(3)硫代硫酸钠()是常用的还原剂。在维生素C(化学式)的水溶液中加入过量溶液,使维生素 完全氧化,剩余的用溶液滴定,可测定溶液中维生素C的含量。发生的反应为:
在一定体积的某维生素C溶液中加入溶液,充分反应后,用溶液滴定剩余的,消耗 溶液.该溶液中维生素C的物质量是
(4)在酸性溶液中,碘酸钠()和亚硫酸钠可发生如下反映:
生成的碘可以用淀粉液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。某同学设计实验如下表所示:

该实验的目的是
II稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位。
(5)钵(Ce)是地壳中含量最高的稀土元素,在加热条件下易发生水解,无水,可用加热和固体混合物的方法来制备。其中,的作用是
(6)在某强酸性混合稀土溶液中加入,调节 ≈3. 通过下列反应形成Ce
(OH)4沉淀得以分离。完成反应的离子方程式:
硼.碳.氮.硅元素的单质及其化合物是构成自然界的重要物质。
(1)硼元素原子核外电子排布式_________________。氮元素原子的核外电子中,未成对电子数与成对电子数之比为 。
(2)甲烷是最简单的有机物,实验室可通讨下列反应制取: ,反应涉及到的物质中,X属于 晶体(填晶体类型),MgO晶体的熔点比CaO高,主要原因是 。
,反应涉及到的物质中,X属于 晶体(填晶体类型),MgO晶体的熔点比CaO高,主要原因是 。
(3)甲硅烷能与硝酸银发生如下反应:SiH4+8AgNO3+2 H2O → 8Ag↓+SiO2↓+8 HNO3该反应中氢元素被氧化,由此可判断非金属性Si比 H (填“强”.“弱”或“无法比较”)
(4)石墨晶体具有层状结构,在层与层之间嵌入金属K原子,能形成石墨夹层离子化合物(KC8),KC8固态时也能导电,导电的粒子是 。
某草酸盐晶体KxFey(C2O4)z•wH2O中铁为+3价,草酸根为-2价,且知x+y+z=7。取该晶体做了以下实验:
① 取4.910g晶体在不同温度下加热至恒重,所得固体的化学式和质量如下表:
| 120℃ |
300℃ |
480℃ |
|
| 化学式 |
KxFey(C2O4)z |
KxFeyO(C2O4)z-1 |
KxFeyO2(C2O4)z-2 |
| 质量 |
4.370g |
3.650g |
2.930 g |
加热到300℃以上时,还生成了一种不常见的碳的氧化物气体(用R表示);
② 另取4.910g晶体,经过加酸溶解、加足量碱沉淀、灼烧至恒重,铁元素全部转化为Fe2O3,质量为0.800g。
(1)计算得出草酸盐晶体中结晶水的质量分数为(保留三位小数);
(2)R的化学式为;
(3)草酸盐晶体的摩尔质量为;
(4)试通过计算,确定草酸盐晶体的化学式。
那格列奈是一种新型的餐时血糖调节剂,适用于Ⅱ型糖尿病。其合成路线如下: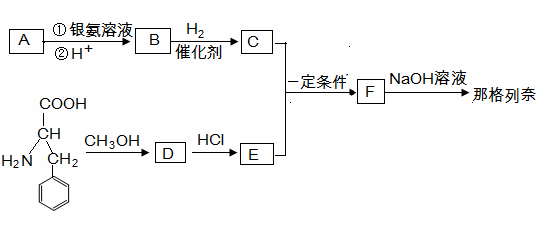
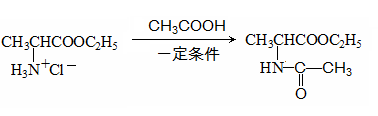
已知: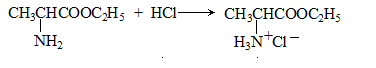
(1)有机物A蒸气密度是相同状态下氢气密度的74倍,A分子中碳元素的质量分数是氢元素质量分数的10倍,A的1个分子中含有1个氧原子, A中含氧官能团的名称为;A的分子式为。
(2)已知A的结构满足以下条件:① 含有苯环,苯环上有两个取代基;
② 苯环上的一溴取代物只有两种;
③ 取代基上有三种不同的氢原子。
写出A的结构简式:
(3)写出流程中制取D的化学方程式:
(4)由F制取那格列奈的反应类型是。
(5)1 mol B与3 mol H2加成得到C,写出C和E制取F的化学方程式:
(6)物质B分子的取代基上一个氢原子被1个溴原子取代后,再消去1个HBr得到有机物G,下列关于G的说法正确的是(选填字母编号)。
a.能使酸性高锰酸钾溶液褪色 b.分子中有7种不同的氢原子
c.能与碳酸氢钠反应放出气体 d.B经上述过程可以得到两种同分异构体
二甘醇又称乙二醇醚,分子式为C4H10O3(HO-CH2-CH2-O-CH2-CH2-OH),二甘醇是一种重要的化工原料,可以制取酸、酯、胺等,用途十分广泛。二甘醇一般的合成路线如下:
过程Ⅰ Br2条件Ⅱ反应Ⅲ
(1)过程Ⅰ是石油加工中常用步骤,其名称为 ;从物质B到物质C的反应条件Ⅱ是 ,该反应属于 (填写反应类型);物质B到物质C的过程如果条件控制不好会生成物质E,E可用于金属的切割,写出B可能生成E的化学方程式 。
(2)写出上述合成路线中的物质A、B、C的结构简式:
A ;B ;C
(3)反应Ⅲ的化学方程式为: 。
已知反应:3I-(aq)+S2O82-(aq)  I3-(aq)+2SO42-(aq)+Q
I3-(aq)+2SO42-(aq)+Q
(1)写出反应的平衡常数表达式:K=。
(2)如图表示反应过程中有关物质的能量,则反应过程中的Q0(填>、<、=);(I)、(II)两曲线中,使用催化剂的是曲线。
(3)反应的速率可以用I3-与加入的淀粉溶液反应显蓝色的时间t来度量,t越小,反应速率越大。下表是在20℃进行实验时所记录的数据
| 实验编号 |
① |
② |
③ |
④ |
⑤ |
| c(I-)/mol·L-1 |
0.040 |
0.080 |
0.080 |
0.160 |
0.160 |
| c(S2O82-)/mol·L-1 |
0.040 |
0.040 |
0.080 |
0.080 |
0.040 |
| t/s |
88 |
44 |
22 |
11 |
t1 |
从表中数据分析,该实验的目的是;
表中显色时间t1=s;最终得出的结论是。