拆开1mol共价键所需吸收的能量如下表:
| 共价键 |
H-H |
N≡N |
N-H |
| 吸收的能量/kJ |
436 |
946 |
391 |
(1)1mol N2完全反应为NH3 (填:吸收或放出) kJ能量
(2)事实上,将1molN2和3molH2放在反应容器中,使它们充分反应,反应的热量变化总小于计算值,原因是 。
FeCl3是一种用途比较广泛的盐。
(1)印刷电路板是由高分子材料和铜箔复合而成。刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”,生成CuCl2和FeCl2。请写出反应的离子方程式。
(2)FeCl3在天然水中可生成氢氧化铁胶体,其沉降水中悬浮物的速度高于铝盐(如硫酸铝等),是城市污水及工业废水处理的高效絮凝剂。实验室制取氢氧化铁胶体的方法是(填字母序号)。
| A.将饱和的FeCl3溶液滴入沸水中,生成棕黄色液体即可。 |
| B.在FeCl3溶液中加入足量的NaOH溶液 |
| C.将饱和的FeCl3溶液滴入沸水,并继续煮沸至生成红褐色液体 |
| D.将饱和的FeCl3溶液滴入沸水,并继续煮沸至生成红褐色沉淀 |
证明此胶体已经制成的最简单方法为。
(3)FeCl3可使湿润的淀粉碘化钾试纸变蓝,化学方程式如下:
2FeCl3+ 2KI = 2FeCl2+ I2+2KI
在上式上用双线桥法标出该反应电子转移的方向和数目。向反应后的溶液中加入CCl4溶液,振荡、静置后会发现下层液体的颜色为色,再将混合液倒入(填仪器名称)中,将两层液体分离。
Ⅰ:某些化学反应可表示为:A+B→C+D+H2O,请回答下列问题:
(1)若A、C、D均含有氯元素,且A中氯元素的化合价介于C与D之间,该反应离子方程式为。
(2)若A为淡黄色固体,C为无色的气体,则该反应的离子方程式为。
(3)若A、C、D均是铁的化合物,B是稀硫酸,则A与B反应的化学方程式为。
Ⅱ:某些化学反应可表示为:A+B+H2O→C+D。请回答下列问题:
(1)若A为非金属单质,C为非金属单质,写出符合要求的化学反应方程式
(2)若A为金属单质,C为非金属单质,写出符合要求的离子方程式_____________________.
(6分)已知A、B、C、D分别是AlCl3、BaCl2、FeSO4、NaOH四种化合物中的一种,它们的水溶液之间的一些反应现象如下:
① A + B→白色沉淀,加入稀硝酸,沉淀不溶解
② B + D→白色沉淀,在空气中放置,沉淀由白色转化为红褐色
③ C + D→白色沉淀,继续加入D溶液,白色沉淀逐渐消失
⑴试推断ABCD(化学式)。
⑵写出下列反应的化学方程式或离子方程式:
①实验②中沉淀由白色转化为红褐色的化学方程式,
②C溶液与D溶液反应后生成的白色沉淀溶解于D溶液中的离子方程式。
太阳能是一种清洁能源,它的利用前景非常诱人。下面是科学家正在研究的一种利用太阳能制取氢气的方法。
(1)首先利用太阳能加热装有氧化锌和木炭的混合物,当反应塔内的温度达到1200 ℃,可得到高纯度的锌粉。然后将制得的高纯度锌与400 ℃以上的水蒸气反应,得到氢气,氧化锌循环使用。请写出该过程涉及的化学方程式________________________、________________________________________________________________________
________________。
(2)若投入81 kg氧化锌粉,则理论上制得的氢气在标准状况下的体积为________L。
绿色有机合成是指采用无毒、无害的原料、催化剂和溶剂,选择具有高选择性、高转化率,不产生或少产生对环境有害的副产品。下列是BHC公司新发明的布洛芬(Ibuprofen)绿色合成方法。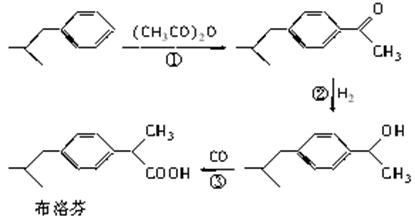
试回答下列问题:
(1)反应③属于羰基合成,反应①、②分别所属的有机反应类型是______________、______________。
(2)反应①的化学方程式为_____________________________________________________
________________________________________________________________________。
(3)与布洛芬互为同分异构体的芳香族化合物中,其结构可表示为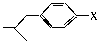 的酯类,X的结构有______种(填数字)。
的酯类,X的结构有______种(填数字)。
(4)某学生提议用Reppe反应一步合成布洛芬,并使原子利用率100%,已知:RCH===CH2+CO+H2O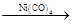 RCH(CH3)COOH,请用一种有机原料合成布洛芬:______________________
RCH(CH3)COOH,请用一种有机原料合成布洛芬:______________________
________________________________________________________________________。