某温度下0.1mol/L Na2CO3溶液中,[Na+]/[CO32—]=20/9>2,其原因是____________,现向Na2CO3溶液中通入一定量的CO2后,[Na+]/[CO32—]=5/2>20/9,其原因是_________,此时[HCO3—]=_____________。
(1)补充完成F表:(请把序号①一⑦的答案对应填入答题卡上)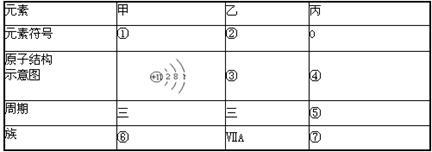
(2)甲元素最高价氧化物对应的水化物呈 性(填“酸、碱”),乙元素对应的最高价氧化物的水化物的化学式为 。
(3)甲与乙两元素的单质反应生成物的电子式为 。
(4)甲单质与丙的氢化物反应的化学方程式为 。
在Cu +2H2SO4(浓)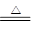 CuSO4+SO2↑+2H2O反应中,______________是氧化剂; ______________元素被氧化; ______________是氧化产物;电子转移总数为______________。
CuSO4+SO2↑+2H2O反应中,______________是氧化剂; ______________元素被氧化; ______________是氧化产物;电子转移总数为______________。
处于下列状态的物质中:①氯化钠晶体 ②干冰 ③液态醋酸 ④铜 ⑤硫酸钡晶体 ⑥蔗糖 ⑦酒精 ⑧熔融的硝酸钾 ⑨NaCl溶液
(1)属于电解质的是(填序号,下同) ;
(2)能导电的是 。
亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3  H+ + H2PO3-。亚磷酸与足量NaOH溶液反应,生成Na2HPO3。
H+ + H2PO3-。亚磷酸与足量NaOH溶液反应,生成Na2HPO3。
(1)①写出亚磷酸与少量NaOH溶液反应的离子方程式____________________________。
②某温度下,0.1000 mol·L-1的H3PO3溶液pH的读数为1.6,即此时溶液中
c (H+) = 2.5×10-2 mol·L-1,除OH-之外其他离子的浓度由小到大的顺序是 ,该温度下H3PO3电离平衡的平衡常数K= 。(H3PO3第二步电离忽略不计,结果保留两位有效数字)
③向H3PO3溶液中滴加NaOH溶液至中性,所得溶液中
c(Na+)_______ c(H2PO3-)+ 2c(HPO32-)(填“>”、 “<” 或“=”)。
(2)亚磷酸具有强还原性,可使碘水褪色,该反应的化学方程式_______________________。
(3)电解Na2HPO3溶液也可得到亚磷酸,装置示意图如下:
说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过。
①阴极的电极反应式为________________________。
②产品室中反应的离子方程式为________________。
A、B、D、E、G 是原子序数依次增大的五种短周期元素。A 与E 同主族,A、B 和E的原子最外层电子数之和为19,B 与G 的单质都能与H2 反应生成“HX”(X 代表B 或G)型氢化物,D 为同周期主族元素中原子半径最大的元素。
(1) B 在元素周期表中的位置是_____________。
(2) D 的两种常见氧化物中均含有____________(填“离子键”或“共价键”)
(3) E 的最高价氧化物对应水化物的浓溶液和木炭共热,反应的化学方程式为_______。
(4) D 的最高价氧化物对应水化物的溶液与G 的单质反应,反应的离子方程式为_______。
(5) 共价键的极性随共用电子对偏移程度的增大而增强,A 和E 所形成氢化物中,共价键
极性的强弱顺序为____________>___________(用化学式表示)。
(6) 用原子结构解释“B、G 单质都能与H2 反应生成HX 型氢化物”的原因:_________。