某兴趣小组对如何延长硫酸亚铁溶液的保质期展开了研究。
(1)制备硫酸亚铁溶液,最合适的试剂组为 (填编号);
a.过量铁屑和稀硫酸 b.过量稀硫酸和铁屑 c.过量硫酸铁溶液和铁屑
(2)实验室保存硫酸亚铁溶液的一般方法是_____________________________________;
该兴趣小组取等体积的硫酸亚铁溶液分别加入三个烧杯中,各滴入3 滴KSCN试剂,然后进行如下实验:
| 烧杯编号 |
① |
② |
③ |
| 加入试剂 |
铁粉0.1g |
铁粉0.1g,0.1mol/LH2SO43mL |
0.1mol/LH2SO43mL |
| 红色出现时间(天) |
1天 |
4天左右 |
8天以上 |
(3)在烧杯②中加入2种试剂后,即可观察到的现象为 ;(4)通过比较上述3组实验,可以得出的结论为 ;
(5)硫酸亚铁溶液在空气中易氧化,氧化产物易水解生成Fe(OH)3,导致溶液酸性增大。
①试用一个离子方程式表示上述反应过程中的变化 ;
②硫酸亚铁溶液在空气中变质的反应为可逆反应,试用化学平衡理论解释烧杯③出现红色最晚的原因 。
某学习小组探究铜跟浓硫酸反应的情况。取6.4g铜片和10mL 18mol·L-1的浓硫酸放在圆底烧瓶中,按下图所示装置进行实验。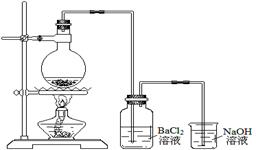
(1)铜和浓硫酸反应的化学方程式为。
(2)实验结束后,发现广口瓶中产生白色沉淀,加入足量盐酸后沉淀几乎完全溶解。简要分析广口瓶中产生沉淀的主要原因:。
(3)实验结束后,发现烧瓶中有铜片剩余。根据所学知识,他们认为烧瓶中还有较多的硫酸剩余。选择合适的试剂,设计简单易行的实验方案证明有余酸:。
供选择的试剂:铁粉、银粉、BaCl2溶液、Na2CO3溶液
(4)甲同学设计如下方案:测定产生气体的量,再计算余酸的浓度。下列测定产生气体的量的实验方法中,不可行的是(填编号)。
a.将气体缓缓通过预先称量、盛有碱石灰的干燥管,反应结束后再次称量
b.将气体通入硫酸酸化的KMnO4溶液,再加足量BaCl2溶液,过滤、洗涤、干燥,称量沉淀
c.用排水法测定产生气体的体积
d.用排饱和NaHSO3的方法测定产生气体的体积
(5)乙同学设计通过酸碱中和滴定来测定余酸的浓度:待烧瓶冷却至室温后,将其中的溶液用蒸馏水稀释至100mL,移取25mL到锥形瓶中,滴加2滴酚酞试液,用标准NaOH溶液滴至终点。平行实验三次。
①稀释时,应先往(填仪器名称)中加入(填“烧瓶中的溶液”或“蒸馏水”)。
②该方法测得的余酸浓度(填“偏大”、“偏小”或“准确”)。
(6)丙设计了测定余酸浓度的较为简易的实验方案:取出反应后剩余的铜片,进行洗涤、干燥、称量。若称得剩余铜片的质量为3.2g,反应后溶液体积变化忽略不计,则剩余硫酸的物质的量浓度为____。
化学实验离不开水。请根据水的不同作用和功能,分析以下四个装置图,回答问题: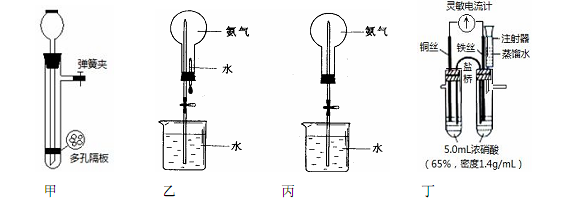
实验一:制取氢气
(1)图甲所示装置可用于实验室制取氢气,这种制气装置在加入反应物前,如何检查气密性。
(2)用锌与稀硫酸制取氢气时,加入少量硫酸铜溶液会加快产生氢气的速率,请解释加快反应速率的原因:。
实验二:喷泉实验
(3)图乙所示装置中烧瓶已装满干燥氨气, 进行喷泉实验时应该先___________(填“挤捏胶头滴管”或“打开止水夹”)。
(4)如果只提供如图丙所示装置,若想迅速引发喷泉,下列方法可行的是 。
a.用热毛巾捂住烧瓶
b.用冰块捂住烧瓶
c.将烧杯中的水换成饱和食盐水
d.向烧杯中加入少量硫酸
实验三:探究一定温度下能使铁钝化的硝酸的最低浓度,实验装置如图丁所示。
①开始实验时,观察到灵敏电流计指针指向铜丝,但又迅速反转指向铁丝;
②再用盛蒸馏水的注射器缓慢向具支试管内加水并振荡,在指针恰好开始反转指向铜丝时停止实验;
③重复三次实验得平均加水量为2.5 mL(水的密度按1.0g/mL计算)。
(5)该实验装置的不足之处是__________________________________。
(6)当指针第一次指向铜丝时,正极的电极反应式为。
(7)根据此实验计算,使铁钝化的硝酸最低质量分数为。
二草酸合铜(Ⅱ)酸钾晶体{K2[Cu(C2O4)2]·2H2O}制备流程如下: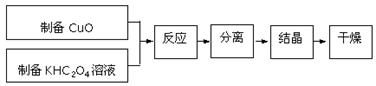
(1)制备CuO:CuSO4溶液中滴入NaOH溶液,加热煮沸、冷却、双层滤纸过滤、洗涤。
①过滤所需的玻璃仪器有
②用蒸馏水洗涤氧化铜时,如何证明氧化铜已洗涤干净
(2)①为提高CuO的利用率,让滤纸上的CuO充分转移到热的KHC2O4溶液中,以下方案正确的是
a.剪碎滤纸,加入到热的KHC2O4溶液中,待充分反应后趁热过滤
b.用稀硫酸溶解滤纸上的氧化铜,然后将溶液转入热的KHC2O4溶液中
c.用氢氧化钾溶液溶解氧化铜,并转入热的KHC2O4溶液中
d.在空气中灼烧滤纸,将剩余的固体转入热的KHC2O4溶液
②50℃水浴加热至反应充分,发生反应的化学方程式为;再经趁热过滤、沸水洗涤、将滤液蒸发浓缩得到二草酸合铜(Ⅱ)酸钾晶体。
(3)本实验用K2CO3粉末与草酸溶液反应制备KHC2O4,此反应进行的主要原因是。
(4)二草酸合铜(Ⅱ)酸钾晶体的制备也可以用CuSO4晶体和K2C2O4溶液反应得到。从硫酸铜溶液中获得硫酸铜晶体的实验步骤为:加入适量乙醇、蒸发浓缩、冷却结晶、过滤、洗涤、干燥。①加入适量乙醇的优点有:
a.缩短加热的时间,降低能耗;
b.。
②在蒸发浓缩的初始阶段还采用了蒸馏的操作,其目的是。
草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,溶液褪色总是先慢后快,某学习小组探究反应过程中使褪色加快的主要原因,过程如下:
【查阅资料】KMnO4溶液氧化H2C2O4的反应历程为: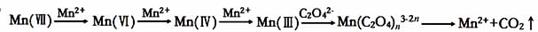
【提出假设】假设1:该反应为放热反应
假设2:反应生成的Mn2+对该反应有催化作用
假设3:K+对该反应有催化作用
该小组同学未提出浓度使反应速率加快的假设,原因是。
【设计、完成实验】
(1)称取g草酸晶体(H2C2O4·2H2O),配置500mL 0.10mol/L H2C2O4溶液。
①在上述过程中必须用到的2种定量仪器是托盘天平和。
②下列操作会使所配溶液浓度偏低的是(填下列选项的字母序号)。
| A.称取草酸晶体时,将草酸晶体放在托盘天平右盘 |
| B.定容时俯视刻度线 |
| C.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水 |
| D.摇匀后,发现溶液液面低于刻度线,立即用胶头滴管加水再定容 |
(2)完成探究,记录数据
| 实验 编号 |
烧杯中所加试剂及用量(mL) |
控制条件 |
溶液褪色时间(s) |
|||
| 0.10mol/L H2C2O4溶液 |
等浓度 KMnO4溶液 |
H2O |
0.50mol/L 稀硫酸 |
|||
| 1 |
30 |
20 |
30 |
20 |
18 |
|
| 2 |
30 |
20 |
30 |
20 |
水浴控制温度65℃ |
15 |
| 3 |
30 |
20 |
30 |
20 |
加入少量MnSO4固体 |
3.6 |
| 4 |
30 |
20 |
x |
20 |
加入5mL 0.10mol/L K2SO4溶液 |
18 |
则x =,假设2成立。
(3)由于KMnO4能氧化水中有机物等因素,为配制好稳定的KMnO4溶液,其浓度需标定。取10.00 mL 0.10mol/L H2C2O4溶液于锥形瓶中,加入10mL 0.50mol/L稀硫酸,用(2)中KMnO4溶液滴定至锥形瓶中恰好呈浅紫色,且半分钟不褪色,记录数据,平行三次实验,平均消耗KMnO4溶液40.00 mL,则草酸溶液与酸性KMnO4溶液反应的离子方程式为。上述实验中KMnO4溶液的物质的量浓度为。
(15分)亚硝酸钠(NaNO2)在纤维纺织品的染色和漂白、照相、生产橡胶、制药等领域有广泛应用,也常用于鱼类、肉类等食品的染色和防腐。但因其有毒,所以在食品行业用量有严格限制。现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物的成分。
已知:①NO+NO2+2OH-===2NO2-+H2O
②气体液化的温度:NO2为21 ℃,NO为-152 ℃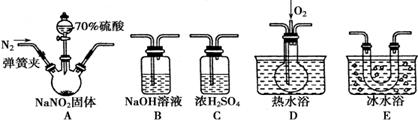
(1)为了检验装置A中生成的气体产物,仪器的连接顺序(按左→右连接)为A、C、________、________、________。
(2)反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气,目的是_________。
(3)在关闭弹簧夹、打开分液漏斗活塞、滴入70%硫酸后,A中产生红棕色气体。
①确认A中产生的气体含有NO,依据的现象是______________。
②装置E的作用是______________________________。
(4)如果向D中通入过量O2,则装置B中发生反应的化学方程式为_____________。如果没有装置C,对实验结论造成的影响是_______________________________。
(5)通过上述实验探究过程,可得出装置A中反应的化学方程式是_________________。