二草酸合铜(Ⅱ)酸钾晶体{K2[Cu(C2O4)2]·2H2O}制备流程如下: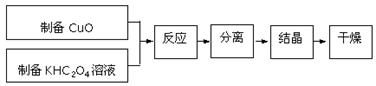
(1)制备CuO:CuSO4溶液中滴入NaOH溶液,加热煮沸、冷却、双层滤纸过滤、洗涤。
①过滤所需的玻璃仪器有
②用蒸馏水洗涤氧化铜时,如何证明氧化铜已洗涤干净
(2)①为提高CuO的利用率,让滤纸上的CuO充分转移到热的KHC2O4溶液中,以下方案正确的是
a.剪碎滤纸,加入到热的KHC2O4溶液中,待充分反应后趁热过滤
b.用稀硫酸溶解滤纸上的氧化铜,然后将溶液转入热的KHC2O4溶液中
c.用氢氧化钾溶液溶解氧化铜,并转入热的KHC2O4溶液中
d.在空气中灼烧滤纸,将剩余的固体转入热的KHC2O4溶液
②50℃水浴加热至反应充分,发生反应的化学方程式为 ;再经趁热过滤、沸水洗涤、将滤液蒸发浓缩得到二草酸合铜(Ⅱ)酸钾晶体。
(3)本实验用K2CO3粉末与草酸溶液反应制备KHC2O4,此反应进行的主要原因是 。
(4)二草酸合铜(Ⅱ)酸钾晶体的制备也可以用CuSO4晶体和K2C2O4溶液反应得到。从硫酸铜溶液中获得硫酸铜晶体的实验步骤为:加入适量乙醇、蒸发浓缩、冷却结晶、过滤、洗涤、干燥。①加入适量乙醇的优点有:
a.缩短加热的时间,降低能耗;
b. 。
②在蒸发浓缩的初始阶段还采用了蒸馏的操作,其目的是 。
下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已省略)。
(1)制备氯气选用的药品为:漂粉精固体和浓盐酸,相关的化学反应方程式为___________________。
(2)装置B中饱和食盐水的作用是_______________;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象________________________。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入_______。
| a |
b |
c |
d |
|
| I |
干燥的有色布条 |
干燥的有色布条 |
湿润的有色布条 |
湿润的有色布条 |
| II |
碱石灰 |
硅胶 |
浓硫酸 |
无水氯化钙 |
| III |
湿润的有色布条 |
湿润的有色布条 |
干燥的有色布条 |
干燥的有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性。当向D中缓缓通入一定量氯气时,可以看到无色溶液逐渐变为______色,说明氯的非金属性大于溴。
(5)打开活塞,将装置D中少量溶液加入装置E中,振荡。观察到的现象是_______。
(6)有人提出,装置F中可改用足量的NaHSO3溶液吸收余氯,试写出相应的离子反应方程式_________,判断改用NaHSO3溶液是否可行______(填“是”或“否”)。
某化学兴趣小组用下图所示装置进行实验,探究硝酸与铁反应的产物。
查阅资料得知:
I.在浓硝酸和活泼金属反应过程中,随着硝酸浓度的降低,其生成的产物有+4、+2、﹣3价等氮的化合物。
II.常温时,NO2与N2O4同时存在;在低于0℃时,几乎只有无色的N2O4的晶体存在。
请回答下列问题:
(1)装置中各仪器装入试剂后,接下来由先至后的操作顺序为 。
| A.通入N2 | B.滴入浓HNO3 | C.打开活塞K1 | D.关闭活塞K1 |
(2)装置A中,滴入浓硝酸加热前没有明显现象的原因是 。
(3)反应结束后,打开装置D中的活塞K2,并通入氧气,铁完全溶解于浓硝酸后生成的NO2气体中含有NO的现象为 。
装置D中发生的反应的化学方程式为 。
(4)C装置的作用是 。
(5)反应停止后,装置A中无固体剩余。证明装置A的溶液中是否含有Fe2+,选择的药品是 (填序号)。
a.铁粉b.氯水c.KMnO4溶液d.硫氰化钾溶液
(6)检验是否生成﹣3价氮的化合物,应进行的实验操作、现象及结论是 。
NOx是汽车尾气中的主要污染物之一。
(1)NOx能形成酸雨,写出NO2转化为HNO3的化学方程式: 。
(2)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
①写出该反应的热化学方程式: 。
②随温度升高,该反应化学平衡常数的变化趋势是_ 。
(3)在汽车尾气系统中装置催化转化器,可有效降低NOX的排放。
①当尾气中空气不足时,NOX在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式: 。
②当尾气中空气过量时,催化转化器中的金属氧化物吸收NOX生成盐。其吸收能力顺序如下:12MgO <20CaO <38SrO<56BaO。原因是 ,元素的金属性逐渐增强,金属氧化物对NOX的吸收能力逐渐增强。
(4)通过NOx传感器可监测NOx的含量,其工作原理示意图如下:
①Pt电极上发生的是 反应(填“氧化”或“还原”)。
②写出NiO电极的电极反应式: 。
二氧化硫和氮氧化物都是常见的大气污染物,回答下列相关问题。
Ⅰ某温度下氮氧化物与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
i.2NO(g)+Cl2(g) 2ClNO(g) △H1<0其平衡常数为K1
2ClNO(g) △H1<0其平衡常数为K1
ii.2NO2(g)+NaCl(s)  NaNO3(s)+ClNO(g) △H2<0其平衡常数为K2
NaNO3(s)+ClNO(g) △H2<0其平衡常数为K2
(1)现有反应4NO2(g)+2NaCl(s)  2NaNO3(s)+2NO(g)+Cl2(g),则此反应的平衡常数K3= (用K1、K2表示),反应热△H3= (用△H1、△H2表示)。
2NaNO3(s)+2NO(g)+Cl2(g),则此反应的平衡常数K3= (用K1、K2表示),反应热△H3= (用△H1、△H2表示)。
(2)为研究不同条件对反应ii的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO2和足够的NaCl(s),10min时反应ii达到平衡。测得平衡时NO2的转化率α1(NO2) =50%,则:
①10min内υ(ClNO) = ,平衡常数K2= ;
②若其它条件不变,使反应在恒压条件下进行,平衡时NO2转化率为α2(NO2),则:
α1(NO2) = α2(NO2)(填“>”“<”或“=”)。
II除氮氧化物外,SO2也是重要的大气污染物,需要对其进行吸收处理。
(3)若用一定量的NaOH溶液吸收SO2气体后所得吸收液恰好呈中性,下列有关吸收液中粒子关系正确的是 。
| A.c(Na+) = c(HSO3-)+ 2c(SO32-) |
| B.c(Na+) > c(HSO3-) =c(SO32-) > c(H+) = c(OH—) |
| C.2c(Na+) =2c(H2SO3)+2c(HSO3-)+2c(SO32-) |
| D.c(Na+) > c(HSO3—) + c(SO32—) +c(H2SO3) |
(4)工业上也可以用Na2SO3溶液吸收SO2,并用电解法处理吸收后所得溶液以实现吸收液的回收再利用,装置如图所示,则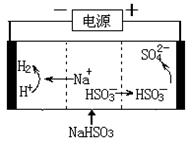
①工作一段时间后,阴极区溶液的pH (填“增大”“减小”或“不变”);
②写出阳极的电极反应式 。
(14分)氨的合成是最重要的化工生产之一。
Ⅰ.工业上合成氨用的H2有多种制取的方法:
①用焦炭跟水反应:C(s)+H2O(g) CO(g) + H2(g);
CO(g) + H2(g);
②用天然气跟水蒸气反应:CH4(g)+H2O(g)  CO(g)+3H2(g)
CO(g)+3H2(g)
已知有关反应的能量变化如下图,且方法②的反应为吸热反应,则方法②中反应的ΔH =________kJ/moL。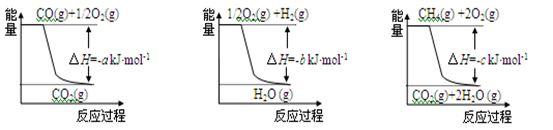
Ⅱ.在3个1L的密闭容器中,同温度下、使用相同催化剂分别进行反应:
3H2(g)+N2(g) 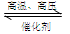 2NH3(g)
2NH3(g)
按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
| 容 器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
3 mol H2、2 mol N2 |
6 mol H2、4mol N2 |
2 mol NH3 |
| 达到平衡的时间(min) |
t |
5 |
8 |
| 平衡时N2的浓度(mol·L-1) |
c1 |
3 |
c2 |
(1)下列能说明该反应已达到平衡状态的是 。
a.容器内N2、H2、NH3的浓度之比为1︰3︰2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
(2)甲容器中达到平衡所需要的时间t 5min,表中c1 c2(填“>”、“<” 或“=”)。
(3)用氨合成尿素的反应为2NH3(g)+CO2(g)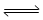 CO(NH2)2(s)+H2O(g)。工业生产时,原料气带有水蒸气。图1表示CO2的转化率与氨碳比
CO(NH2)2(s)+H2O(g)。工业生产时,原料气带有水蒸气。图1表示CO2的转化率与氨碳比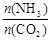 、水碳比
、水碳比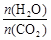 的变化关系。
的变化关系。
①曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是 。
②测得B点氨的转化率为30%,则x1= 。
Ⅲ.有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图2所示。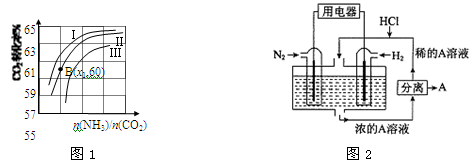
电池正极的电极反应式是 ,A是 。