某学习小组探究铜跟浓硫酸反应的情况。取6.4g铜片和10mL 18mol·L-1的浓硫酸放在圆底烧瓶中,按下图所示装置进行实验。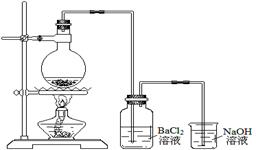
(1)铜和浓硫酸反应的化学方程式为 。
(2)实验结束后,发现广口瓶中产生白色沉淀,加入足量盐酸后沉淀几乎完全溶解。简要分析广口瓶中产生沉淀的主要原因: 。
(3)实验结束后,发现烧瓶中有铜片剩余。根据所学知识,他们认为烧瓶中还有较多的硫酸剩余。选择合适的试剂,设计简单易行的实验方案证明有余酸: 。
供选择的试剂:铁粉、银粉、BaCl2溶液、Na2CO3溶液
(4)甲同学设计如下方案:测定产生气体的量,再计算余酸的浓度。下列测定产生气体的量的实验方法中,不可行的是 (填编号)。
a.将气体缓缓通过预先称量、盛有碱石灰的干燥管,反应结束后再次称量
b.将气体通入硫酸酸化的KMnO4溶液,再加足量BaCl2溶液,过滤、洗涤、干燥,称量沉淀
c.用排水法测定产生气体的体积
d.用排饱和NaHSO3的方法测定产生气体的体积
(5)乙同学设计通过酸碱中和滴定来测定余酸的浓度:待烧瓶冷却至室温后,将其中的溶液用蒸馏水稀释至100mL,移取25mL到锥形瓶中,滴加2滴酚酞试液,用标准NaOH溶液滴至终点。平行实验三次。
①稀释时,应先往 (填仪器名称)中加入 (填“烧瓶中的溶液”或“蒸馏水”)。
②该方法测得的余酸浓度 (填“偏大”、“偏小”或“准确”)。
(6)丙设计了测定余酸浓度的较为简易的实验方案:取出反应后剩余的铜片,进行洗涤、干燥、称量。若称得剩余铜片的质量为3.2g,反应后溶液体积变化忽略不计,则剩余硫酸的物质的量浓度为____。
(14分)黄铁矿(主要成分为FeS2)是我国大多数硫酸厂制取硫酸的主要原料。某化学学习小组对某黄铁矿石进行如下实验探究。
[实验一]测定硫元素的含量。
Ⅰ、将m1 g该黄铁矿样品放入如图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2 + 11O2 2Fe2O3 + 8SO2
2Fe2O3 + 8SO2
Ⅱ、反应结束后,将乙瓶中的溶液进行如下处理:
|
[实验二]测定铁元素的含量。
III、测定铁元素含量的实验步骤如图所示。
某化学小组利用浓盐酸和二氧化锰在加热条件下制取氯气,并利用氯气进行有关的探究实验,甲同学设计了如图所示的实验装置。
A B
(1)写出制取氯气反应的离子方程式 __________________________;装置中使用分液漏斗而不使用长颈漏斗的原因是_______________________________________
_____________________________________________________________________;
实验时为了除去氯气中的氯化氢气体,最好在A、B之间安装盛有试剂的净化装置。
(2)若用含有0、2molHCl的MnO2反应制氯气,制得Cl2体积(标准状况下)总是小于1、12L的原因。
(3)已知:H2CO3 H++HCO3- Ka1 =4.45×10-7
H++HCO3- Ka1 =4.45×10-7
HCO3- H++CO32- Ka2=5.61×10-11
H++CO32- Ka2=5.61×10-11
HClO H++ClO- Ka=2.95×10-8
H++ClO- Ka=2.95×10-8
请根据以上碳酸和次氯酸的电离常数,写出下列条件下发生反应的离子方程式:①将少量氯气通入过量的碳酸钠溶液中______________________________。
⑷乙同学认为甲同学的实验有缺陷,提出在位置后(填字母)增加一个装置,该装置中应加入试剂,其作用。
X、Y、Z、W均为含有10电子的微粒,W为金属阳离子,X、Y、Z常温下为气体,
(1)已知: W + X + H2O → 白色沉淀。
①若实验室用下图所示装置、干燥和收集装置制取并收集干燥的X,A中分液漏斗中的液态试剂的仪器的名称是________,仪器的连接顺序为a→________________________;
②由W离子形成的可溶性盐WCln,其水溶液显_________性,原因是(用离子方程式表示)_____________________________________________________
③为进一步确定W,进行如下实验,请补全实验操作、现象和结论:取上述白色沉淀少量置于试管中,_____________________________________________________
(2)常温下,取10 mLpH= a的Y的稀溶液,加水稀释时pH随溶液体积V的变化如图所示,则①Y的化学式为__________。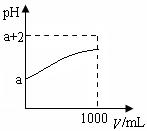
②下列有关Y的叙述正确的是__________
| A.Y溶于水后部分发生电离 |
| B.Y的水溶液中滴加石蕊试液会变红 |
| C.稀释后溶液中所有离子的浓度均减小 |
| D.稀释后,阴离子的物质的量浓度之和不变 |
③一定量X溶液和一定量的Y的溶液混合,所得溶液中离子浓度的等式关系为:
(用实际离子符号表示)
(3)已知H2的燃烧热为285.8 kJ·mol-1。现有Z和H2的混合气体共0.2 mol,与O2完全燃烧生成H2O(l)和CO2(g),转移电子的物质的量为1.0 mol,放出的热量为117.6 kJ。写出Z完全燃烧的热化学反应方程式__________________________________
2008年9月以来,三聚氰胺成为人们谈论的焦点。某同学为了测定三聚氰胺的分子式和结构简式。设计了如下实验。他查阅资料得知:三聚氰胺的相对分子质量为126,三聚氰胺在常温下为晶体,在加热条件下能与氧气发生反应生成二氧化碳、氮气和水。现有12.6g三聚氰胺晶体按下图所示实验装置反应(假设三聚氰胺完全转化成产物)。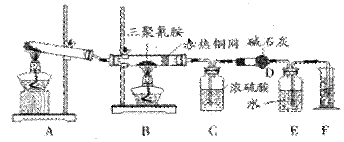
(1)写出A装置中发生反应的化学方程式:______________________________ ________
(2)C装置能不能与D装置互换?(填“能”或“不能”),理由是___________,___
_。
(3)当B装置中反应完全发生后,读取F中水的体积,实验操作顺序为__________(填序号)。
①读数②冷却至室温③调平E、F装置中液面
(4)测定数据如下:
经测定,收集到的气体折合成标准状况下的体积为6.72L。
①利用上述实验数据,通过计算可知三聚氰胺的实验式为_____________。
②三聚氰胺的分子式为_____________________。
③若装置中没有铜网,则对测定结果的影响是_____________________。
(5)已知氰酸(HCN)的结构简式为H—C≡N,氰胺的结构简式为H2N一C≡N,三聚氰胺分子中每个原子的最外层电子数均为8或2,则其结构简式为
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯。回答下列问题:
(1)写出制取乙酸乙酯的化学反应方程式,并指出其反应类型:_____ _________ ,属于_______________反应。
(2)浓硫酸的作用是:①_________________________;②____________________。
(3)装置中通蒸气的导管要插在_____________溶液的液面上,不能插入溶液中,目的是防止_______ 。
(4)若要把制得的乙酸乙酯分离出来,应采用的实验操作是___________。
A.蒸馏 B.分液 C.过滤 D.结晶
(5)用30克乙酸与46克乙醇反应,如果实际产率是理论产率的67%,则可得到乙酸乙酯的质量是______________。
A.29.5克 B.44克 C.74.8克 D.88克