工业上一般在恒容密闭容器中用H2和CO生产燃料甲醇,反应方程式为
CO(g)+2H2(g)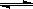 CH3OH(g)△H
CH3OH(g)△H
(1)下表所列数据是反应在不同温度下的化学平衡常数(K)。
| 温度 |
250°C |
300°C |
350°C |
| K |
2.041 |
0.270 |
0.012 |
①由表中数据判断△H 0(填“>”、“=”或“<“)
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为 ,此时的温度为 。
(2)在100℃压强为0.1 MPa条件下,容积为V L某密闭容器中a mol CO与 2a mol H2在催化剂作用下反应生成甲醇,达平衡时CO的转化率为50%,则100℃该反应的的平衡常数K= (用含a、V的代数式表示并化简至最简单的形式)。此时保持温度容积不变,再向容器中充入a mol CH3OH(g),平衡___ __(向正反应方向、向逆反应方向)移动,再次达到新平衡时,CO的体积分数 。(减小、增大、不变)
(3)要提高CO的转化率,可以采取的措施是 。
A.升温 B.加入催化剂 C.增加CO的浓度
D.恒容充入H2 E.恒压充入惰性气体 F.分离出甲醇
(4)判断反应达到平衡状态的依据是(填字母序号,下同) 。
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
(5)300°C,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡的有关数据如下:
| 容器 |
甲 |
乙 |
丙 |
|
| 反应物投入量 |
1molCO、2moL H2 |
1molCH3OH |
2molCH3OH |
|
| 平 衡 时 的 数 据 |
CH3OH浓度(mol/L) |
c1 |
c2 |
c3 |
| 反应的能量变化 |
akJ |
bkJ |
ckJ |
|
| 体系压强(Pa) |
p1 |
p2 |
p3 |
|
| 反应物转化率 |
α1 |
α2 |
α3 |
请选择正确的序号填空(不定项选择)
① c1、c2、c3的关系表达正确的为______
A c3>2c1 B c1<c3<2c1 C c1=c2
②p1、p2、p3的关系不正确的为________
A p1=p2 B p2<p3<2p2 C p3>2p2
③ a1、a2、a3的关系表达不正确的为________
A a1=a2 B a3< a2 C a1+a2=1
下列叙述正确的是
| A.在共价化合物中一定存在共价键 |
| B.只存在共价键的物质一定是共价化合物 |
| C.含有共价键的化合物一定是共价化合物 |
| D.离子化合物中只含有离子键 |
某主族元素R的最高正化合价与最低负化合价的代数和为6,由此可以判断
| A.R可能是第二周期元素 |
| B.R一定是ⅥA族元素 |
| C.R的气态氢化物比同周期其它元素气态氢化物稳定 |
| D.R气态氢化物化学式为H2R |
下列物质中,既有离子键又有共价键的是
| A.CaCl2 | B.KOH | C.H2O | D.H2SO4 |
不能说明氧元素比硫元素非金属性强的事实是
| A.热稳定性H2O比H2S强 |
| B.H2S水溶液在空气中变浑浊 |
| C.H2O比H2S的沸点高 |
| D.在一定条件下,O2与Cu反应生成CuO,S与Cu反应生成Cu2S |
元素性质呈周期性变化的根本原因是
| A.核外电子排布呈周期性变化 | B.元素的相对原子质量逐渐增大 |
| C.核电荷数逐渐增大 | D.元素化合价呈周期性变化 |