一定条件下,向某容器中加入2molA、2molB,使反应2A+mB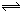 nC+D达到平衡时,气体A的浓度为w mol/L、体积分数为v%。
nC+D达到平衡时,气体A的浓度为w mol/L、体积分数为v%。
(1)若容积不变,且B为固体,达到平衡时再加入n molC和1molD,气体A的浓度为2w mol/L、体积分数仍为v%(假定n molC是足量的),则n= 时,C、D均为气体;n= 时,C为气体,D为固体或液体。
(2)若容积不变,且A、B、C、D均为气体,当m=2、n=3时,在相同条件下的另一容器中要达到平衡时气体A的浓度仍为w mol/L,则需在起始时加入C mol、D mol。
(3)若压强不变,且A、B、C、D均为气体,当m=2、n=3时,在已达到平衡的容器中再加入C和D,使达到平衡时气体A的浓度仍为w mol/L,则再加入C、D的物质的量之比为n(C):n(D)=
在下列物质转化中,A是一种正盐,D的相对分子质量比C的相对分子质量大16,E是酸;当X无论是强酸还是强碱时,都有如下的转化关系: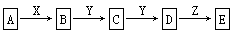
当X是强酸时A、B、C、D、E均含同一种元素;当X是强碱时,A、B、C、D、E均含另外同一种元素。(已知H2CO3、H2S、H2SiO3皆为二元弱酸)
请回答:
(1)A是________,Y是________,Z是________。 (填化学式,下同)
(2)当X是强酸时,E是________,写出B生成C的化学方程式:___________________
(3)当X是强碱时,E是________,写出B生成C的化学方程式:__________________
铁及其化合物在日常生活、生产中应用广泛.研究铁及其化合物的应用意义重大.
I.水体的净化和污水的处理与铁及其化合物密切相关.
(1)自来水厂常用高铁酸钠(Na2FeO4)改善水质.简述高铁酸钠用于杀菌消毒同时又起到净水作用的原理 .
(2)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
| 开始沉淀 |
2.3 |
7.5 |
3.4 |
| 完全沉淀 |
3.2 |
9.7 |
4.4 |
回答下列问题:
①写出反应I中主要发生的氧化还原反应的离子方程式 .
②加入少量NaHCO3的目的是调节溶液pH,应控制pH的范围为 .
③在实际生产中,反应II常同时通入O2以减少NaNO2的用量,若通入5.6L O2(标准状况),则相当于节约NaNO2的质量为 g.
④碱式硫酸铁溶于水后产生的[Fe(OH)]2+离子,可部分水解生成[Fe2(OH)4]2+聚合离子.该水解反应的离子方程式为 .
II铁的化合物也是制备高能锂电池的重要原料.已知磷酸亚铁锂电池总反应为:FePO4+Li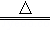 LiFePO4,电池中的固体电解质可传导Li+.试写出该电池充电时的阳极反应式 .
LiFePO4,电池中的固体电解质可传导Li+.试写出该电池充电时的阳极反应式 .
(1)环境专家认为可以用铝将水中的NO3﹣ 转化为N2,从而清除污染.该反应中涉及的粒子有:H2O、Al、OH﹣、Al(OH)3、NO3﹣、N2,请将各粒子分别填入以下空格(请将整个方程式配平后写在答题纸上).
NO3﹣+ + → + + ﹣ 该反应过程中,被氧化与被还原的元素的物质的量之比为 .
(2)若4Al(s)+3O2(g)=2Al2O3(s)△H=﹣a KJ/mol
Fe2O3(s)+C(s)=CO2(g)+2Fe (s)△H="+b" KJ/mol
C(s)+O2(g)=CO2(g)△H=﹣c KJ/mol
写出Al与氧化铁发生铝热反应的热化学方程式: .
(3)将一定质量的钠铝合金置于水中,合金全部溶解,得到20mL PH=14的溶液,然后用2mol/L的盐酸滴定,可得到沉淀量与消耗的盐酸体积关系如图:则反应过程中产生氢气的总体积为 L(标准状况)
氰(CN)2、硫氰(SCN)2的化学性质和卤素很相似,化学上称为“类卤素”,它们阴离子的还原性强弱为:Cl﹣<Br﹣<CN﹣<SCN﹣<I﹣.
试写出:
(1)(CN)2与KOH(aq)反应的化学方程式: ;
(2)NaBr和KSCN的混合溶液中加入足量(CN)2反应的离子方程式: .
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量铝粉和铁粉的混合物与一定体积某浓度的稀硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入5 mol·L-1的NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量关系如图所示。则
(1)B与A的差值为________mol;
(2)原硝酸溶液中含硝酸的物质的量为________mol;
(3)铝粉和铁粉的混合物中铝粉与铁粉的物质的量之比为________;
(4)写出铝与该浓度硝酸反应的离子方程式____________。