(5分)下列各组组物质中,属于同位素的是(1)_______;属于同素异形体的是(2)____;
互为同分异构体的是(3)_____;属于同系物的是(4)______;属于同种物质的是(5)______。
| A.O2和O3 | B.CH3CH2CH2CH3和CH3CH(CH3)2 | C.35Cl和37Cl | D.CH3(CH2)3CH3和CH3CH3 |
E .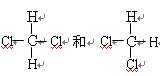
物质的量浓度相同的①氨水;②氯化铵;③碳酸氢氨;④硫酸氢氨;⑤硫酸氨5种溶液中,c(NH4+)的大小顺序是_____。
水体中重金属铅的污染问题备受关注。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)、Pb(OH)  ,各形态的浓度分数α随溶液pH变化的关系如下图所示:
,各形态的浓度分数α随溶液pH变化的关系如下图所示:
(1)Pb(NO3)2溶液中,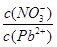 ________2(填“>”“=”或“<”);往该溶液中滴入氯化铵溶液后,
________2(填“>”“=”或“<”);往该溶液中滴入氯化铵溶液后,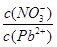 增加,可能的原因是________________________________。
增加,可能的原因是________________________________。
(2)往Pb(NO3)2溶液中滴入稀NaOH溶液,pH=8时溶液中存在的阳离子(Na+除外)有__________,pH=9时主要反应的离子方程式为_______________________。
(3)某课题组制备了一种新型脱铅剂,能有效去除水中的痕量铅,实验结果如下表:
| 离 子 |
Pb2+ |
Ca2+ |
Fe3+ |
Mn2+ |
Cl- |
| 处理前浓度/(mg·L-1) |
0.100 |
29.8 |
0.120 |
0.087 |
51.9 |
| 处理后浓度/(mg·L-1) |
0.004 |
22.6 |
0.040 |
0.053 |
49.8 |
上表中除Pb2+外,该脱铅剂对其他离子的去除效果最好的是________。
(4)如果该脱铅剂(用EH表示)脱铅过要发生的反应程中主为:2EH(s)+Pb2+ E2Pb(s)+2H+则脱铅的最合适pH范围为( )
E2Pb(s)+2H+则脱铅的最合适pH范围为( )
A.4~5B.6~7 C.9~10D.11~12
已知在25℃的水溶液中,AgX、AgY、AgZ均难溶于水,但存在沉淀溶解平衡。当达到平衡时,溶液中离子浓度的乘积是一个常数(此常数用Ksp表示,Ksp和水的Kw相似)。
如:AgX(s) Ag+(aq)+X-(aq)
Ag+(aq)+X-(aq)
Ksp(AgX)===c(Ag+)·c(X-)=1.8×10-10
AgY(s) Ag+(aq)+Y-(aq)
Ag+(aq)+Y-(aq)
Ksp(AgY)===c(Ag+)·c(Y-)=1.0×10-12
AgZ(s) Ag+(aq)+Z-(aq)
Ag+(aq)+Z-(aq)
Ksp(AgZ)=c(Ag+)·c(Z-)=8.7×10-17
(1)根据以上信息,判断AgX、AgY、AgZ三者的溶解度(用已被溶解的溶质的物质的量/1 L溶液表示)S(AgX)、S(AgY)、S(AgZ)的大小顺序为________________________________________________________________________。
(2)若向AgY的饱和溶液中加入少量的AgX固体,则c(Y-)________(填“增大”、“减小”或“不变”)。
(3)在25℃时,若取0.188 g的AgY(相对分子质量188)固体放入100 mL水中(忽略溶液体积的变化),则溶液中Y-的物质的量浓度为________。
(4)①由上述Ksp判断,在上述(3)的体系中,能否实现AgY向AgZ的转化?________,并简述理由:_________________________________________________________。
②在上述(3)体系中,能否实现AgY向AgX的转化?________,根据你的观点选答一项。
若不能,请简述理由:________________________________________________。
若能,则实现转化的必要条件是_________________________________________。
(1)写浓盐酸与二氧化锰加热反应来制取氯气的化学方程式。
(2)写出氢氧化钡溶液与稀硫酸反应的离子方程式。
甲、乙、丙、丁分别是盐酸、碳酸钠、氯化钙、硝酸银4 种溶液中的一种。将它们两两混合后,观察到的现象是:
①甲与乙或丙混合都产生沉淀;
②丙与乙或丁混合也产生沉淀;
③丁与乙混合产生无色气体。回答下面问题:
(1)写出丁与乙反应的离子方程式:。
(2)这四种溶液分别是:甲:、乙:、丙:、丁: