小冉和小海两位同学在实验室中进行化学实验。小冉将CO2通入澄清的石灰水中;小海向盛有少量NaOH溶液的试管中滴入几滴酚酞溶液,再倒入一定量的稀盐酸。
(1)小冉同学观察到的现象 ,该反应的化学方程式为 ;
(2)小海同学实验后发现试管内溶液为无色,认为氢氧化钠和盐酸恰好完全反应.你认为他的观点是否正确 (填“是”或“否”),你的理由是:
;
(3)实验结束后,两名同学将反应后的剩余物同时倒入废液缸中,发现有气泡产生,废液仍然为无色。请你和两名同学一起对废液缸中废液的组成进行探究。
【提出问豫】废液中的溶质除指示剂外,还有什么?
【进行猜想】①两位同学一致认为溶质为CaCl2和NaCl:
②你认为溶质的组成还可能为 。
【实验验证】向废液中加入 ,出现 现象。
【实验结论】说明猜想 (填①或②)正确。
【实验反思】为减少废液对环境的污染,可采取的方法是 。
【拓展延伸】通过酚酞溶液由红色变无色,说明NaOH已与盐酸完全反应,你认为还可以向反应后的溶液中加入 (不使用紫色石蕊试液和pH试纸)来证明NaOH确已完全反应。
下图所示是Ca(OH)2的部分性质实验,回答有关问题。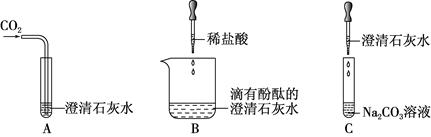
(1)A中的实验现象是;
(2)B中发生反应的化学方程式为;
(3)将这三个实验后的所有物质倒入同一洁净的烧杯中,静置,观察到上层溶液为无色,底部有白色沉淀。取少量上层溶液与足量稀盐酸混合,无明显现象。综合分析可知:上层溶液中一定含有的溶质是酚酞和① ,可能含有的溶质是 ②
我们的日常生活离不开金属。
(1)铁 生锈是铁与空气中的水蒸气、_等发生化学反应的过程。
(2)在探究铁、铜、锌、银的金属活动性顺序时,某小组做了如下三个实验: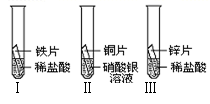
(所用金属的形状与大小和稀盐酸的用量均相同)
①一段时间后,可观察到实验Ⅱ的现象是;
反应的化学方程式是
②小组中的甲同学认为:通过实验Ⅰ和Ⅲ可比较出锌和铁的金属活动性强弱。你认为他依据的实验现象是。
③乙和丙两位同学认为上述三个实验不能够得出四种金属的活动性顺序,原因
是;
并在上述实验的基础上,补充了一个实验(右图所示),实现了探究目的。他们的实验:X是金属______,Y是__________溶液(写出化学式)。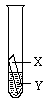
某班同学按下图所示的实验探究质量守恒定律。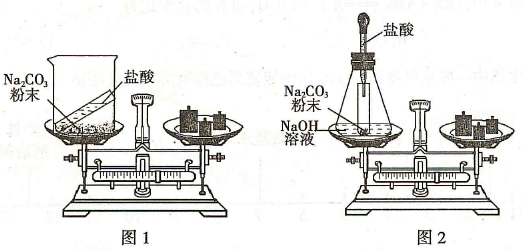
(1)同学们先按图1的方式实验,将盐酸加到碳酸钠粉末中发生反应的化学方程式为。该实验中,大家进行了两次称量,有四个小组得到下列数据,其中有问题的两组数据是(填序号)。
| A |
B |
C |
D |
|
| 盐酸加入 粉末前称量/ | 85.3 |
82.8 |
84.8 |
86.5 |
| 盐酸加入 粉末后称量/ | 85.3 |
80.6 |
83.2 |
87.8 |
(2)同学们又按照图2的方式实验,当天平平衡后,挤压胶头滴管逐滴滴人盐酸,最终天平的状态是(填序号)。
A.左盘高 B.右盘高 C.保持平衡
该实验中通过化学反应新生成了的物质有(填序号)。
A.
B.
C.
D.
以下是氯化钠溶液的配制和粗盐中难溶性杂质的去除(需要计算粗盐的产率)实验活动中的部分操作。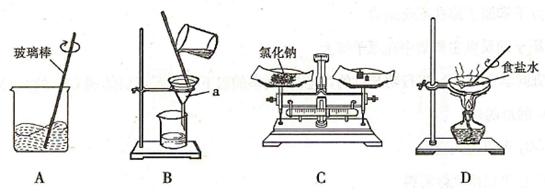
(1)仪器
的名称是。
(2)配制6%的氯化钠溶液和粗盐中难溶性杂质的去除都要用到的实验操作是(填序号)。
(3)
中玻璃棒搅拌的作用是使氯化钠。如果
中的滤液仍然浑浊,就应该。
操作中,当观察到蒸发皿中出现时,停止加热。
对比学习有利于发现事物的共性与个性.为探究酸的性质,同学们进行了如下实验.
| 实验内容 |
实验现象 |
分析与结论 |
 |
醋酸晶体试管内 (1),醋酸溶液试管中镁带表面冒气泡. |
酸的很多反应通常在水溶液中才能完成. |
用玻璃棒蘸硫酸在白纸上写字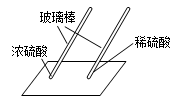 |
(2) (填"浓"或"稀")硫酸使白纸炭化. |
即使是同种酸,由于 (3)不同,它们的性质不完全相同. |
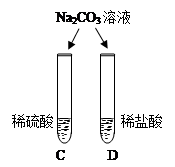 |
两试管中均产生 (4) |
不同的酸具有相似的性质,这是因为酸的组成中都含有(5)(填元素符号). |
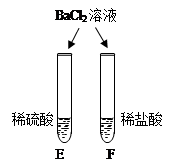 |
试管中产生 (6), 试管中无明显现象. |
不同的酸根会导致酸的"个性"差异.因此,可用氯化钡溶液鉴别盐酸和硫酸. |
清洗试管时,小乔同学将
两试管中的无色液体同时倒入一个洁净的废液缸,废液缸中立刻冒气泡并出现白色沉淀.请分析上述现象并回答:
Ⅰ.废液缸中产生气体的化学方程式为(7).
Ⅱ.废液缸里最终产生的白色沉淀中一定有硫酸钡,可能有(8)(填化学式).