无机化合物可根据其组成和性质进行分类,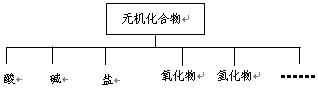
(1)上图所示的物质分类方法名称是 。
| 物质类别 |
酸 |
碱 |
盐 |
氧化物 |
氢化物 |
| 化学式 |
①H2SO4 ② |
③NaOH ④ |
⑤Na2SO4 ⑥ |
⑦SO2 ⑧SO3 |
⑨NH3 |
(2)以K、Na、H、O、S、N中任两种或三种元素组成合适的物质,分别填在上表中②、④、⑥后面。(请写在答题卡对应空格中)
(3)写出⑦转化为⑧的化学方程式 。
(4)若实验室需要2mol/L的硫酸溶液450ml,配制时所需的主要仪器有烧杯、玻璃棒、
量筒、 、 ,如用质量分数为98%、密度为1.84 g/cm3的浓硫酸进行稀释,
所需浓硫酸的的体积为__________mL(计算结果保留一位小数)
(5)实验室制备⑨常用 和 反应,检验该气体的方法是 。
五羧基全铁[Fe(CO)5]是一种浅黄色液体,熔点-20.5℃,沸点103℃,易溶于苯 等有机溶剂,不溶于水,密度1.46—1.52g/cm3,有毒,光照时生成Fe2(CO)9,60℃发生自燃,可用着汽油抗爆剂,催化剂等。五羰基合铁的制备原理如下:
等有机溶剂,不溶于水,密度1.46—1.52g/cm3,有毒,光照时生成Fe2(CO)9,60℃发生自燃,可用着汽油抗爆剂,催化剂等。五羰基合铁的制备原理如下:
(1)五碳基合铁中铁的化合价为。
(2)下列说法正确的是。
| A.利用上述反应原理可制备高纯铁 |
| B.制备Fe(CO)5应在隔绝空气的条件下进行 |
C.反应Fe(s)+5CO(g)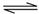 Fe(CO)5(g)的平衡常数表达式为 Fe(CO)5(g)的平衡常数表达式为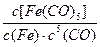 |
| D.Fe(CO)5应密封、阴凉、避光并加少量蒸馏水液封贮存。 |
(3)五碳基合铁能与氢氧化钠溶液反应生成Na2Fe(CO)4和另两种常见无机物,该反应的化学方程式为。
(4)今将一定量的Fe(CO)5的苯溶液,用紫外线照射片颏。取照射后的 溶液11.72g完全燃烧,得到30.536gCO2、5.4gH2O及1.6g红棕色粉末。
溶液11.72g完全燃烧,得到30.536gCO2、5.4gH2O及1.6g红棕色粉末。
①红棕色粉末的化学式为。
②照射后的溶液中Fe(CO)5与Fe2(CO)9的物质的量之比为 。
。
苏罗同(Serotone)是一种镇吐药,其合成路线如下: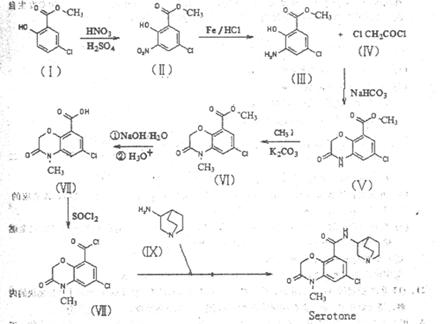
(1)化合物I的核磁工段振氢谱有个峰。
(2)化合物Ⅱ中含氧官能团有(任意写出两个)。
(3)Ⅲ+Ⅳ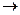 Ⅴ中NaHCO3gm V
Ⅴ中NaHCO3gm V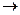 Ⅵ中K2CO3的主要作用是。
Ⅵ中K2CO3的主要作用是。
(4)写出下列反应的
①Ⅱ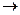 Ⅲ,②Ⅶ
Ⅲ,②Ⅶ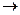 Serotone.
Serotone.
(5)已知:①当苯环上有-OH、-NH2、烃基时,苯环上再引入基团时进入其邻、对位;当苯环上有COOH、-NO2-SO3H时,苯环上再引入基团时进入其间位。
②苯胺具有弱碱性,易被强氧化剂氧化。
③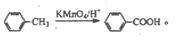
试画出以甲苯和乙醇为原料合成苯唑卡因(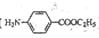 )的合成路线流程图(必要条件需注明,无机试剂任选)。合成路线流程图示例如下:
)的合成路线流程图(必要条件需注明,无机试剂任选)。合成路线流程图示例如下: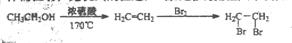
过氧化氢是一种重要的化学产品,在工农业生产和日常生活中有着广泛应用,工业采用烷基薏醌法生产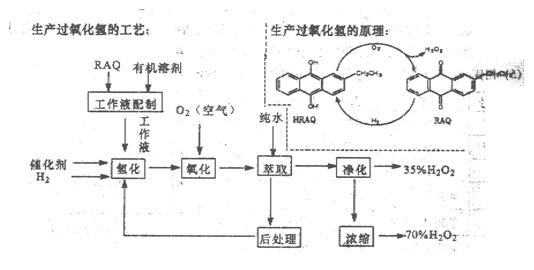
根据生产过氧化氢原理和工艺,回答下列问题:
(1)该生产过氧化氢的原理中,原子利用率为。
(2)该工艺中有机溶剂为液态烷烃和酯类,能否用乙醇代替?
(3)为了提高经济效益,该工艺氢化反应,除了加催化剂外,还可采取的措施是。
A.适当加热 B.加压 C.增大工作液中有机溶剂的量
(4)该工艺中“后处理”的目的是。
(5)该工艺中由35%的H2O2得到70%的H2O2可采取操作方法是。
(6)硫酸酸化的过氧化氢溶液可溶解金属铜,试写出该反应的离子方程式为。
天然气中伴随有H2S等合硫化合物,脱硫方法有多种:
(1)一种湿法脱硫是用碳酸钾溶液吸收其中的H2S,同时生成两种酸式盐,该反应的化学方程为。
(2)一种于法脱硫,其涉及反应:H2(g)+CO(g)+SO2(g)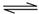 H2O(g)+CO2(g)+S(s)
H2O(g)+CO2(g)+S(s) 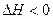 ,高脱硫率可采取的措施是。
,高脱硫率可采取的措施是。
a.高压 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出硫
(3)用脱硫剂ZDE—01的海绵铁法脱硫,可实现常温脱硫
①脱硫:Fe2O3·H2O(s)+3H2S(g)=Fe2S3·H2O(s)+3H2O(g) 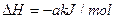
②再生:2Fe2S3·H2O(s)+3O2(g)=2Fe2O3·H2O(s) +6S(s)
+6S(s)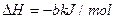
则2H2S(g)+O2(g)=2H2O(g)+2S(s)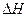 =(用a、b表示)
=(用a、b表示)
(4)一种改进的克劳斯法脱硫的工艺,化学反应如下 :
:
H3S+1.5O2=H2O+SO2 SO2+0.5O2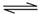 SO3
SO3
SO3(g)+H2O(g)=H2SO4(g) H2SO4(g)+0.17H2O(g)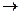 H2SO4(a
H2SO4(a q)
q)
该法最终得到的硫酸溶液的质量分数为。
某工厂对制革工业污泥中 Cr(Ⅲ)回收与再利用工艺如下(硝酸浸取液中金属离子主要是 Cr3+,其次是Fe3+、Ca2+、Mg2+)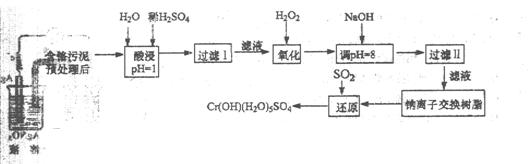
| 氢氧化物 |
Fe(OH)3 |
Mg(OH)2 |
Al(OH)3 |
Cr(OH)3 |
| pH |
3.7 |
11.1 |
8 |
9(>9溶液) |
部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见上表。
(1)酸浸时,为了提高浸取率可采取的措施(至少写一条)。
(2)调pH=8是为了除去离子(选填:Fe3+、Al3+、Ca2+、Mg2+)。
(3)钠离子交换树脂的原理为:Ma++nNaR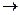 MRa+nNa+,被交换的杂质离子是(选填:Fe3+、Al3+、Ca2+、Mg2+)。
MRa+nNa+,被交换的杂质离子是(选填:Fe3+、Al3+、Ca2+、Mg2+)。
(4)试配平还原反应方程式:Na2Cr2O7+SO2+H2O=Cr(OH)(H2O)5SO4+
Na2SO4;每生成1mol Cr(OH)(H2O)5SO4消耗SO2的物质的量为 。
。