(9分)甲、乙是同主族非金属元素组成的单质,乙通常状况下是深红棕色液体。X、Y是化合物。X溶液呈淡绿色。它们之间有如下图所示转化关系。
请回答:
(1)实验室制取甲的化学方程式为___________________________________________。
若制得标准状况下2.24 L甲,则被氧化的物质的质量为________。
(2)将甲通入石蕊溶液中发生的颜色变化为
请在方框内填写出导致该阶段颜色变化的粒子符号。
(3)将Y溶液滴入沸水可得红褐色液体,反应的离子方程式是___________________。
(4)取100 mL 0.1 mol/L的X溶液,通入一定量的甲时,共转移1.204×1022个电子,该反应的离子方程式是________________________________________________________
________________________________________________________________________。
(5)在一种酸性溶液中可能存在Fe3+、NO3-、Cl-、I-中的一种或几种离子,向该溶液中加入乙,乙被还原,由此可推断溶液中一定含有________离子;一定不含有________离子。
已知蓝铜矿的主要成分是2CuCO3·Cu(OH)2,受热易分解。铝土矿的主要成分是Al2O3、Fe2O3、SiO2。已知NaAlO2+CO2+H2O=Al(OH)3↓+NaHCO3,根据下列框图转化回答问题: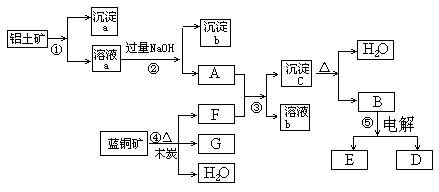
(1)写出②的离子方程式:______________________、_____________________。
(2)沉淀a、c化学成分分别是: ___ ___、__ ____。
(3)请写出检验沉淀b中所含有阳离子的实验方法_______________________________
(4)洗涤沉淀c的实验操作方法是____________________________________________
加热沉淀c应放在___________容器中进行。
(5)经过④、⑤步反应得到铜和金属铝,写出反应的化学方程式:______________________、____________________________________________。
【有机化学基础】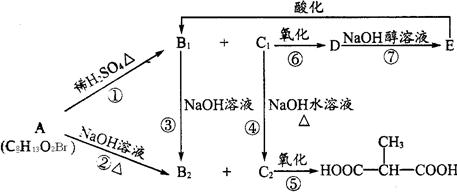
有机物A有如下变化,其中只有B1既能使溴水褪色,又能和Na2CO3溶液反应生成CO2。
(l)C1中含有的官能团有____________ 。
(2)已知CH2=CH—OH不稳定,写出B1既可以发生银镜反应,又可以与金属钠发生反应的所有链状同分异构体的结构筒式:_______________________
(3)写出A与C2的结构简式:
A:_____________ ;C2:__________________ 。
(4)写出反应①与③的反应类型:
①_____________ 反应;③____________反应。
(5)写出反应②的化学方程式_____________________ 。
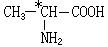 有机分子中碳原子连接四个不同的原子或原子团时,称为不对称碳原子(或手性碳原子),以*C表示,具有手性碳原子的有机物具有光学活性。如
有机分子中碳原子连接四个不同的原子或原子团时,称为不对称碳原子(或手性碳原子),以*C表示,具有手性碳原子的有机物具有光学活性。如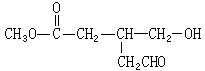 ①标出下列有机物X中的手性碳原子:
①标出下列有机物X中的手性碳原子:
②若使有机物X通过化学变化,使生成物中不再具有手性碳原子从而失去光学活性,可能发生的反应类型有___________________。(只限一步转化)
已知:C是一种合成树脂,用于制备塑料和合成纤维,D是一种植物生长调节剂,用它可以催熟果实。根据以下化学反应框图填空:
 |
(1)写出A的电子式;C的结构简式;
(2)写出苯和液溴反应生成E的化学方程式;
其反应类型为。
已知某有机物的相对分子质量为58。根据下列条件回答:
若该有机物的组成只有C、H,则此有机物的分子式为;若它的核磁共振氢谱只有2个峰,则它的结构简式为。