(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化方程式是  。
。
(2)肼一空气燃料电池是一种碱性燃料电池,电解质溶液是20%—30%的 KOH溶液。
肼—空气燃料电池放电时:
正极的电极反应式是 。
负极的电极反应式是
(3)右图是一个电化学过程示意图。
①锌片上发生的电极反应是 。
②假设使用肼一空气燃料电池作为本过程中的电源,铜片的质量变化128g,则肼一空气燃料电池理论上消耗标标准状况下的空气 L(假设空气中氧气体积含量为20%)
[化学——有机化学基础]
有甲、乙、丙三种物质: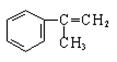


甲乙丙
(1) 乙中能发生消去反应的官能团为____________________。
(2)由甲转化为乙需经下列过程(已略去各步反应的部分产物,下同):
反应Ⅱ的条件是NaOH溶液、加热;反应III的化学方程式为________________________
(不需注明反应条件)。
(3)由甲出发合成丙的路线之一如下: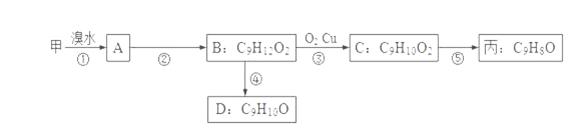
①下列物质不能与B反应的是___________(选填序号)。
a.金属钠 b.FeCl3溶液 c.Na2CO3溶液 d.HBr溶液
②C的结构简式为 __________________________;第⑤步反应类型______________________
③任写一种能同时满足下列条件的D的同分异构体的结构简式______________________。
a.苯环上的一氯代物有两种 b.遇FeCl3溶液发生显色反应 c.能与Br2/CCl4发生加成反应
[化学——物质结构与性质]
I.氮族元素包括N、P、As、Sb和Bi五种元素。
(1)下列关于氮族元素的说法正确的是。
a.N2可用于填充霓虹灯,其发光原理是电子从能量较低的轨道跃迁到能量较高的轨道时以光的形式释放能量
b.P、Na、S三种元素的第一电离能由大到小的顺序是:P>S>Na
c.基态As原子中,电子占据的最高能级为4d
d.Bi原子中最外层有5个能量相同的电子
(2)NH3在水中的溶解度比PH3大得多,其原因是。
向硫酸铜溶液中先加过量氨水,后加适量乙醇,溶液中析出深蓝色的[Cu(NH3)4]SO4晶体,
该晶体中不含有的化学键是。
| A.极性键 | B.非极性键 | C.离子键 | D.配位键 E.氢键 |
Ⅱ. 第四周期金属与人类的生产生活息息相关。
(3)目前市售的发光二极管,其材质以砷化镓(GaAs) 为主。已知镓是与铝同族,镓的基态原子的电子排布式是 。GaAs中Ga的化合价为 。
(4)金属钛坚硬、强度大、耐热、密度小,被称为高技术金属。TiCl4在常温下是无色液体,在水或潮湿空气中易水解而冒白烟, 则TiCl4属于 (填“原子”“分子”或“离子”)晶体。
(5) 钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,其中一种的化学式为[Co(NH3)5Br]SO4,往其溶液中加BaCl2溶液时,产生白色沉淀; 往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时, 产生淡黄色沉淀,则第二种配合物的化学式为 。
我国化工专家侯德榜,改进氨碱法设计了“联合制碱法”,为世界制碱工业作出了突出贡献。生产流程如下: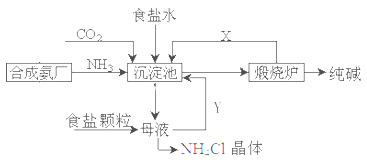
(1)完成有关反应的化学方程式
①沉淀池: NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl
②煅烧炉:
(2)联合制碱法的优点表述中,不正确的是___________
A.生产原料为:食盐、NH3、CO2
B.副产物氯化铵可做氮肥
C.生产过程中可循环利用的物质只有CO2
D.原料利用率高
某实验小组,利用下列装置模拟“联合制碱法”的第一步反应。
(3)上述装置中接口连接顺序为;
A.a接c;b接f、e接d B.a接d;b接f、e接c
C.b接d;a接e、f接cD.b接c;a接f、e接d
(4)D中应选用的液体为。
为测定产品纯碱的成分和含量,做如下实验。假设产品纯碱中只含NaCl、NaHCO3杂质。
(5)检验产品纯碱中是否含有NaCl,可取少量试样溶于水后,再滴加 试剂。
(6)滴定法测定纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品W g,放入锥形瓶中加蒸馏水溶解,加1~2滴酚酞指示剂,用c mol/L的HCl溶液滴定至溶液由红色变为无色(指示CO32- +H+=HCO3-反应的终点),所用HCl溶液体积为V1 mL,再加1~2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄色变为橙色,所用HCl溶液总体积为V2 mL。则纯碱样品中NaHCO3质量分数为 。
碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
| 开始沉淀 |
2.3 |
7.5 |
3.4 |
| 完全沉淀 |
3.2 |
9.7 |
4.4 |
回答下列问题:
(1)加入少量NaHCO3的目的是调节pH在范围内。
(2)反应Ⅱ中加入NaNO2的目的是氧化亚铁离子,写出该反应的离子方程式为
。
(3)实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2体积为 11.2 L(标准状况),则相当于节约NaNO2的物质的量为。
(4)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解生成Fe2(OH)42+ 聚合离子,该水解反应的离子方程式为。
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为。
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
(6)为测定含Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:准确量取20.00mL溶液于带塞锥形瓶中,加入足量H2O2,调节pH<3,加热除去过量H2O2;加入过量KI充分反应后,再用 0.1000 mol·L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。
已知:
则溶液中铁元素的总含量为g·L-1。若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会
(填“偏高” “偏低” “不变”)
中国环境监测总站数据显示,颗粒物(PM2.5等)为连续雾霾过程影响空气质量最显著的污染物,其主要为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 |
K+ |
Na+ |
NH |
SO |
NO |
Cl- |
| 浓度/mol•L-1 |
4×10-6 |
6×10-6 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据计算PM2.5待测试样的pH = 。
(2) NOx是汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
① N2(g)+O2(g) 2NO(g)△H=。
2NO(g)△H=。
②当尾气中空气不足时,NOx在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式。
③ 汽车汽油不完全燃烧时还产生CO,有人设想按下列反应除去CO:
2CO(g)=2C(s)+O2(g),已知该反应的△H>0,该设想能否实现?。
(3)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
① 用离子方程式表示反应器中发生的反应 。
② 用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是。
③ 用吸收H2后的稀土储氢合金作为电池负极材料(用MH表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量、长寿命的镍氢电池。电池充放电时的总反应为:Ni(OH)2+M  NiO(OH)+MH,电池放电时,负极电极反应式为 ; 充电完成时,全部转化为NiO(OH),若继续充电,将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸。
NiO(OH)+MH,电池放电时,负极电极反应式为 ; 充电完成时,全部转化为NiO(OH),若继续充电,将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸。