(8分)聚氯乙烯(PVC)保鲜膜的安全问题引起广泛的关注。PVC的安全隐患主要来自于塑料中残留的PVC单体以及不符合国家标准的增塑剂DEHA。工业上用乙烯和氯气为原料经下列各步合成PVC:乙烯一定条件①甲一定条件②乙一定条件③PVC
(1)乙是PVC的单体,其结构简式为__________________________________________;
(2)反应③的化学方程式为__________________________________________________;
(3)写出以下反应类型:
反应①__________________;反应②________________。
(4)邻苯二甲酸辛酯(DOP)是国家标准中允许使用的增塑剂之一,邻苯二甲酸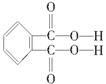 是制造DOP的原料,它跟过量的甲醇反应能得到另一种增塑剂DMP(分子式为C10H10O4),DMP属于芳香酯,其结构简式为
是制造DOP的原料,它跟过量的甲醇反应能得到另一种增塑剂DMP(分子式为C10H10O4),DMP属于芳香酯,其结构简式为
______________________________________。
(5)聚甲基丙烯酸羟乙酯的结构简式为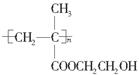 ,它是制作软质隐形眼镜的材料。请写出下列有关反应的化学方程式:
,它是制作软质隐形眼镜的材料。请写出下列有关反应的化学方程式:
①由甲基丙烯酸羟乙酯制备聚甲基丙烯酸羟乙酯______________________________;
②由甲基丙烯酸制备甲基丙烯酸羟乙酯______________________________________;
③由乙烯制备乙二醇___________________________________________________。