某同学对氧气的实验室制法作了以下探究,请根据下图回答下列问题:
A B C D E F
(1)写出标有序号的仪器的名称
a b c
(2)若加热氯酸钾和二氧化锰混合物制取干燥氧气,则发生装置选_____,此装置用于加热高锰酸钾制氧气应做怎样改动:________________________,收集装置选__ __。
若实验室用过氧化氢溶液制较纯净的氧气,请写出该反应的符号表达式
,若发生装置选C,该装置与A相比的优越性是:_______________
但要注意 ,收集装置选_____。
(3)已知颗粒状的锌和稀硫酸在常温下反应即可制得氢气,我们可为其选择的发生装置是 ,收集装置是 。(已知氢气是一种密度最小的气体,难溶于水)
下图所示为实验室中常见的气体制备、干燥、收集和探究物质性质的常用仪器。试根据题目要求,回答下列问题: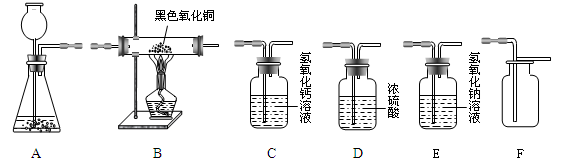
(1)若以过氧化氢溶液和二氧化锰为原料在实验室中制备并收集干燥的氧气。
①所选仪器的连接顺序为 (填写仪器序号字母)。
②生成氧气时,所发生反应的化学方程式为
③A装置中长颈漏斗下端管口插入液面以下的原因是 。
(2)连接装置B、C可用来验证CO的还原性,装置B中可以看到的现象是黑色粉末变红色,装置C中出现白色沉淀。写出装置C中发生反应的化学方程式是 。
(3)将CO2气体通入装置E中,则装置E中溶液的质量与之前相比会 (填写序号)。
A.减小 B.不变 C.增大D.无法判断
蔬菜的搭配饮食很有讲究,某同学对“菠菜中富含可溶性草酸盐和碳酸盐,与豆腐同食会引起结石”的说法很感兴趣,于是对这一问题进行了探究。
探究:菠菜里是否含有可溶性草酸盐和碳酸盐?
【查阅资料】
①可溶的草酸盐、碳酸盐能与CaCl2溶液反应生成难溶于水的草酸钙(CaC2O4)、碳酸钙。
②醋酸(化学式用HAc表示)不与草酸钙反应,但能与碳酸钙反应生成可溶性盐。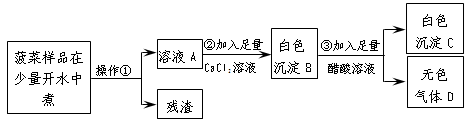
【实验流程】
根据流程回答问题:
(1)操作①的名称是 。
(2)加入足量CaCl2溶液的目的是 。
(3)已知气体D能使澄清石灰水变浑浊,步骤③中发生反应的化学方程式为: 。
【实验结论】菠菜里含有可溶性草酸盐和碳酸盐。
【问题讨论】菠菜中含有大量的草酸盐,而普通豆腐中含有大量的钙,菠菜和豆腐一起吃可形成不溶性的沉淀,从而导致结石。但豆腐中富含钙和蛋白质,菠菜中也含有大量的营养成分,如七大营养素中不能被直接消化和吸收的 等都是人体必需的。所以,合理搭配饮食非常重要。
(8分)根据如图所示装置回答有关问题:
(1)写出下列仪器名称M ;N
(2)若用装置B排水收集氧气,气体从 (填“a”或“b”)导管通入瓶内;瓶底留少量水进行装置C中的实验,水的作用是 .
(3)对比装置D和C,可以得出关于可燃物燃烧的条件是 .
(4)某同学连接A、E、F进行实验,A中所加药品不同,F中所加药品相同。
①若实验时E中蜡烛熄灭,F中溶液变浑浊,说明A中产生的气体所具有的性质为 。
②若实验时E中蜡烛燃烧更旺,F中溶液变浑浊,则A中反应的化学方程式为 。
③C中铁丝燃烧的化学方程式为 .
根据下图回答问题。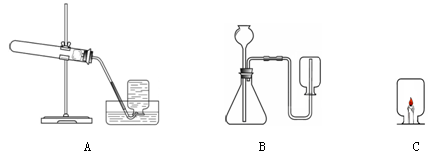
(1)实验室用A制取氧气,反应的化学方程式是 ,还需补充的仪器是 。
(2)实验室用B制取二氧化碳,反应的化学方程式是 ,装置中要改正的是 ,将燃着的木条放在集气瓶口,若观察到 ,说明集气瓶中已充满二氧化碳。
(3)将上述实验收集的一瓶气体倒扣在燃着的蜡烛上(如图C所示),观察到蜡烛火焰更加明亮,一段时间后逐渐熄灭,则集气瓶中原有的气体是 。
(4)成语“釜底抽薪”的本意包含着灭火的原理,下列灭火方法也依据这个原理的是
| A.用锅盖盖灭着火的油锅 |
| B.用二氧化碳灭火器灭火 |
| C.砍掉树木形成隔离带 |
| D.消防队员用高压水枪灭火 |
过氧化钠(Na2O2)是一种淡黄色固体。在一次科技活动中,某化学兴趣小组的同学将包有Na2O2固体的棉花放入了如图1的实验中,发现了高低不同的两根蜡烛,下面的蜡烛先熄灭,上面的蜡烛后熄灭;同时也惊奇地发现棉花燃烧了起来。
(1)实验过程中“下面的蜡烛先熄灭,上面的蜡烛后熄灭”的现象说明二氧化碳具有
、 的性质。
(2)棉花为什么会燃烧呢?小组同学认为棉花要燃烧,除了满足“棉花是可燃物”这一条件,还另需满足a: 、 b: 两个条件。
[提出问题]:在上述实验中是如何给棉花提供a和b这两个燃烧条件的呢?
[查阅资料]:1、在常温下Na2O2和CO2能发生化学反应。
2、无水硫酸铜为白色固体,吸水后变为蓝色。
[设计实验]:经过讨论后,小组同学设计了如下图2的实验进行探究。

[实验步骤]:①检查整套装置的气密性;②把相关的试剂放入对应的仪器内(D装置的U型管内放有足量的Na2O2固体,烧杯内盛有饱和的澄清石灰水),并按图2组装整套实验仪器;③用力推动针筒的活塞,把稀盐酸注入试管内;④一段时间后,在P处放置一根带火星的小木条,观察现象。
注:整个实验中不考虑稀盐酸的挥发和空气对实验的影响。
[实验现象]:①无水硫酸铜没有变蓝色;②带火星的小木条复燃;③饱和的澄清石灰水变浑浊。
[实验分析]:①浓硫酸的作用是: 。
②D装置的烧杯内澄清石灰水变浑浊的原因是 。
[得出结论]:①“小木条复燃”说明Na2O2和CO2反应产生的一种气体,使图1中的棉花满足了燃烧的一个条件;②“饱和的澄清石灰水变浑浊”说明Na2O2和CO2反应将 能转化为热能,使图1中的棉花满足了燃烧的另一个条件。
[拓展提高]:①Na2O2和CO2反应除生成一种气体外,还生成了一种固体,小明认为生成的固体是NaOH,小红认为是Na2CO3,同学们经过思考后认为 同学的猜想是错误的,理由是: 。
②Na2O2和CO2反应的化学方程式是 。