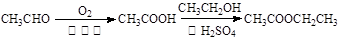(10)[物质结构].甲、乙、丙、丁为前三周期元素形成的微粒,它们的电子总数相等。已知甲、乙、丙为双原子分子或负二价双原子阴离子,丁为原子。
(1)丙与钙离子组成的离子化合物跟水反应产生一种可燃性气体,反应的化学程式是 ___________________________________
(2)乙在高温时是一种还原剂,请用化学方程式表示它在工业上的一种重要用途:___________________________________
(3)在一定条件下,甲与O2反应的化学方程式是 _______________________
(4)丁的元素符号是_________,它的核外电子排布式为 _______________________
(5)丁的氧化物的晶体结构与_________________ 的晶体结构相似。
有增长碳链是有机合成中非常重要的反应。例如:
反应①
用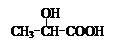 通过以下路线可合成(Ⅱ):
通过以下路线可合成(Ⅱ):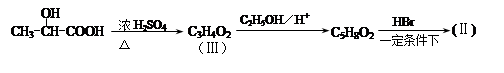
(1)(Ⅰ)的分子式为 ;1mol该物质完全燃烧需要消耗 mol O2.。
(2)(Ⅱ)与足量的热NaOH溶液反应的化学方程式为 。
(Ⅲ)的结构简式为 ;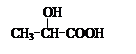 在生成(Ⅲ)时,还能得到另一种副产物C6H8O4,该反应的化学方程式为 ,该反应的反应类型是 。
在生成(Ⅲ)时,还能得到另一种副产物C6H8O4,该反应的化学方程式为 ,该反应的反应类型是 。
(4)对二氯苯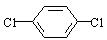 也能与有机物(Ⅰ) (过量)发生类似反应①的系列反应,其生成有机物的结构简式为 。
也能与有机物(Ⅰ) (过量)发生类似反应①的系列反应,其生成有机物的结构简式为 。
课题组以甲苯为主要原料,采用以下路线合成化妆品防霉剂:对—羟基苯甲酸乙酯。
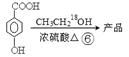
请回答:
(1)有机物C7H7Br的名称为 。
(2)产品的摩尔质量为 。
(3)在①~⑥的反应中属于取代反应的有 。
(4) 在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式) 。
在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式) 。
(5) 的同分异构体很多,其中符合下列条件有 种。
的同分异构体很多,其中符合下列条件有 种。
①遇到FeCl3溶液出现显色现象;②能发生水解反应;③能发生银境反应;④无-CH3结构。上述同分异构体中核磁共振氢谱显示其有5种峰的结构简式为 。
(6)高分子化合物 是一种建筑材料,根据题中合成路线信息,以甲苯为原料合成该高分子化合物,请设计合成路线(无机试剂及溶剂任选)。注:合成路线的书写格式参照如下示例流程图:
是一种建筑材料,根据题中合成路线信息,以甲苯为原料合成该高分子化合物,请设计合成路线(无机试剂及溶剂任选)。注:合成路线的书写格式参照如下示例流程图: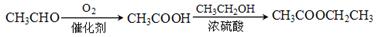
。
有机物A〜M有如图所示转化关系,A与F分子中所含碳原子数相同,且均能与 NaHCO3溶液反应,F的分子式为C9H10O2,且不能使溴的CCl4溶液褪色;D能发生银镜反应;M与NaOH溶液反应后的产物,其一氯代物只有一种。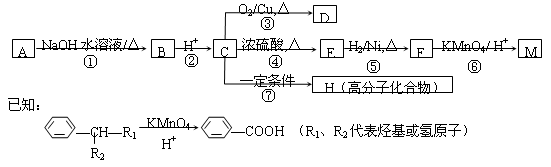
请回答:
(1)B、F的结构简式分别为 、 。
(2)反应①〜⑦中,属于消去反应的是 (填反应序号)。
(3)D发生银镜反应的化学方程式为 ;反应⑦的化学方程式为 。
(4)A的相对分子质量在180~260之间,从以上转化中不能确认A中的某一官能团,确定该官能团的实验步骤和现象为 。
(5)符合下列条件F的同分异构体共有 种。
a.能发生银镜反应
b.能与FeCl3溶液发生显色反应
c.核磁共振氢谱上有四个峰,其峰面积之比为1:1:2:6
Grignard试剂(卤代烃基镁)广泛运用于有机合成中,Grignard试剂的合成方法是:RX+Mg RMgX(Grignard试剂)。生成的卤代烃基镁与具有羰基结构的化合物(醛、酮等)发生反应,再水解就能合成各种指定结构的醇:
RMgX(Grignard试剂)。生成的卤代烃基镁与具有羰基结构的化合物(醛、酮等)发生反应,再水解就能合成各种指定结构的醇: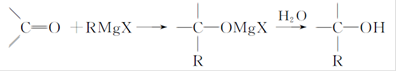
现以2-丁烯和必要的无机物为原料合成3,4-二甲基-3-己醇,进而合成一种分子式为C10H16O4的具有六元环的物质J,该物质具有对称性。合成线路如下: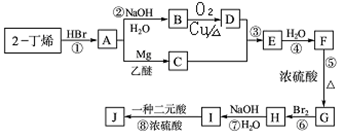
请按要求填空:
(1)用系统命名法对物质B进行命名: ;
(2)在I-J过程中所加入的二元酸的结构简式为: ;
(3)反应①~⑧中属于取代反应的有 个;属于消去反应的有 个.
| A.1个 | B.2个 | C.3个 | D.4个 |
(4)写出下列过程的反应方程式(有机物请用结构简式表示):
B→D ;
I→J ;
(5)写出一种满足以下条件的D的同分异构体的结构简式。
①能与Na反应反出H2;②核磁共振氢谱有四组峰;③有二种官能团。(注:羟基不能与碳碳双键中的碳原子直接相连)
某研究小组以甲苯为主要原料,采用以下路线合成医药中间体F和Y。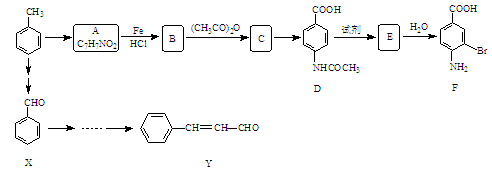
已知: 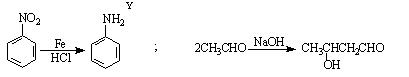
请回答下列问题:
(1)下列说法正确的是 。
| A.F的分子式是C7H7NO2Br |
| B.甲苯的一氯取代物有3种 |
| C.F能发生取代反应和缩聚反应 |
| D.1mol 的D最多可以和5 mol H2发生加成反应 |
(2)D→E的反应类型是 。
(3)B→C的化学方程式是 。在合成F的过程中,B→C步骤不能省略,理由是 。
(4)C→D反应所需的试剂是 。
(5)写出同时符合下列条件的A的同分异构体的结构简式 (写出3个)。
①苯环上只有两种不同化学环境的氢原子②分子中含有
(6)以X和乙烯为原料可合成Y,请设计合成路线(无机试剂及溶剂任选)。注:合成路线的书写格式参照如下示例流程图: