维拉佐酮是临床上使用广泛的抗抑郁药,其关键中间体合成路线如下:
已知:
回答下列问题:
(1)反应类型:①________________④________________
(2)A和D的结构简式分别为:________________;________________
(3)写出反应②的化学方程式:_________________。实验中反应②在K2CO3弱碱性条件下进行的原因是:____________。
(4)同样具有三个支链,且支链结构与B完全相同,属于芳香族化合物的B的同分异构体一共有________种(不包括B)
(5)反应⑥中(Boc)2O是由两分子羧酸C5H10O3脱水形成的酸酐,且(Boc)2O分子中氢原子化学环境只有1种,写出(Boc)2O的结构简式:
(6) 实验室还可用 和
和  直接反应生成E,但实验中条件控制不当会发生副反应生成副产物,写出副产物有机物的结构简式________。
直接反应生成E,但实验中条件控制不当会发生副反应生成副产物,写出副产物有机物的结构简式________。
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛的应用。请回答下列问题:
(1)氨气可由N2和H2反应制取,N2(g)+3H2(g)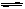 2NH3(g)反应过程的能量变化如图所示:
2NH3(g)反应过程的能量变化如图所示:
已知:1molN2分子中的化学键断裂时需要吸收942kJ的能量;1molH2分子中的化学键断裂时需要吸收436kJ的能量;形成1mol N—H键时释放390.8kJ的能量。
①图中A、C分别表示、,E的大小对该反应的反应热有无影响?。
该反应需要用铁触媒作催化剂,加铁触媒会使图中B点升高还是降低?理由。
②图中△H=kJ·mol-1。
③如果反应速率ν(H2)为0.15mol· L-1·min-1,则ν(N2)=mol· L-1·min-1 ν(NH3)=
mol·L-1·min-1。
(2)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:N2(g)+2O2(g)=N2O4(l)△H= -19.5kJ·mol-1
N2H4(l)+O2(g)= N2(g)+2H2O(g)△H= -534.2kJ·mol-1
请写出肼和 N2O4反应的热化学反应方程式。
近年来,乳酸成为研究热点之一。乳酸可以用化学方法合成,也可以由淀粉通过发酵法制备。利用乳酸 为原料制成的高分子材料具有生物兼容性,而且在哺乳动物体内或自然环境中都可以最终降解成为二氧化碳和水。乳酸还有许多其他用途。
为原料制成的高分子材料具有生物兼容性,而且在哺乳动物体内或自然环境中都可以最终降解成为二氧化碳和水。乳酸还有许多其他用途。
(1)请写出乳酸分子中官能团的名称、。
(2)乳酸能与纯铁粉反应制备一种补铁药物
该反应中的还原剂是____________
(3)乳酸聚合成的纤维非常适合做手术缝合线,其原因是
。
(4)乳酸发生下列变化
所用的试剂是a,b(写化学式)
(5)请写出下列反应的化学方程式,并注明反应类型:
①乳酸与乙醇的反应;
X、Y、W、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示。已知X的一种核素的质量数为18,中子数为10,Y和Ne原子的核外电子总数相差1;W的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最大。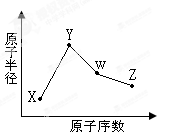
(1)W位于元素周期表中第周期第族画出X的阴离子的结构示意图。
(2)Z的氢化物和溴化氢相比,较稳定的是(写化学式);Z的氢化物与氟化氢相比,沸点较高的是(写化学式)。
(3)Y的金属性与Mg的金属性相比,(写化学式)的金属性强,请用实验证明它们金属性的相对强弱:。
(4)写出Y的最高价氧化物对应的水化物与Z的最高价氧化物对应的水化物发生反应的化学反应方程式。
[化学——选修有机化学基础]
Ⅰ.请选出下列各题中符合题意的选项:
(1)下列不可能存在的有机物是
A.2—甲基丙烷 B.2,3—二氯—2,2—二甲基戊烷
C.3—溴—3—乙基戊烷 D.2,2,3,3—四甲基丁烷
(2)能在KOH的醇溶液中发生消去反应的是
(3)某有机物既能发生氧化反应,又能发生还原反应,且氧化产物和还原产物能发生酯化反应,所生成的酯也能发生银镜反应。则该有机物的结构简式是
A.CH3OH B.HCHO
C.HCOOH D.HCOOCH3
Ⅱ.有机物A的结构简式为:
据此回答下列问题:
(1)A的分子式为__________。
(2)A在NaOH水溶液中加热,经酸化得到有机物B和D,D是芳香族化合物。当有1 mol A发生反应时,最多消耗mol NaOH。
(3)B在一定条件下发生酯化反应可生成某五元环酯,该五元环酯的结构简式为。
(4)写出苯环上只有一个取代基且属于酯类的D的所有同分异构体的结构简式:。
[化学——选修物质结构与性质]
Ⅰ.请选出下列各题中符合题意的选项:
(1)下列物质中,属于含有共价键的离子晶体是
A.CsCl B.KOH C.H2O D.H2
(2)已知CsCl晶体的密度为 ,NA为阿伏加德罗常数,相邻的两个Cs+的核间距为a cm,如图所示,则CsCl的摩尔质量可以表示为
,NA为阿伏加德罗常数,相邻的两个Cs+的核间距为a cm,如图所示,则CsCl的摩尔质量可以表示为
A. g/mol B.
g/mol B. g/mol
g/mol
C. g/mol D.
g/mol D. g/mol
g/mol
(3)已知含氧酸可用通式XOm(OH)n来表示,如X是S,m=2,n=2,则这个式子就表示H2SO4。一般而言,该式中m的值越大,该含氧酸的酸性越强。下列各含氧酸中酸性最强的是
A.HMnO4 B.H2SeO3 C.H3BO3 D.H3PO4
Ⅱ.现有部分前四周期元素的性质或原子结构如下表:
| 元素编号 |
元素性质或原子结构 |
| A |
原子的电子排布图为 |
| B |
常温下单质为双原子分子,原子间形成三对共用电子对 |
| C |
原子的s轨道电子数等于p轨道电子数,元素的最低负价为-2价 |
| D |
二价阳离子与C的阴离子具有相同的电子层结构 |
| E |
原子序数是D两倍, |
根据以上情况,回答下列问题:(答题时A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为;
(2)B的氢化物的分子空间构型是;
(3)E在周期表中的位置是,ECl3能与B、C的氢化物形成配位数为6的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界,ECl3形成的配合物的化学式为;
(4)AC2在高温高压下所形成的晶胞如右图所示。该晶体的类型属于(选填“分子”、“原子”、“离子”或“金属”)晶体,该晶体中A原子的杂化形式为;
(5)D 的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:。