按系统命名法命名
(1)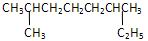 的系统命名是:
的系统命名是:
(2) 的键线式是
的键线式是
(3)3—甲基—2—戊烯的结构简式是
有下列物质:①Cl2②Na2O2③NaOH④HCl⑤H2O2⑥MgF2⑦NH4Cl
(1)属于离子化合物是___________;属于共价化合物是___________;
(2)只由离子键构成的物质是________;
(3)只由极性键构成的物质是________;只由非极性键构成的物质是________;
(4) 由极性键和非极性键构成的物质是______________;
(5) 由离子键和极性键构成的物质是_____________;
(6) 由离子键和非极性键构成的物质是________________。
反应混合物A、B、C的物质的量浓度与时间t(s)关系如表所示。
该反应方程式为。
用A浓度变化表示200~800 s内反应的平均反应速率为mol/L·min。
| t |
200 |
400 |
800 |
| A |
1.45 |
1.28 |
1.00 |
| B |
0.38 |
0.72 |
1.28 |
| C |
0.095 |
0.18 |
0.32 |
如图所示,把试管放入盛有25 ℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5 mL盐酸于试管中。试完成下列问题: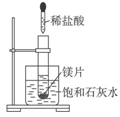
(1)实验中观察到的现象是______________________________________。
(2)产生上述现象的原因是______________________________________。
(3)写出有关反应的离子方程式:________________________________。
(4)由实验推知,MgCl2溶液和H2的总能量_____________(填“大于”“小
于”或“等于”)镁片和盐酸的总能量。
已知:铅蓄电池总的化学方程式为:Pb+PbO2+2H2SO4⇋ 2H2O+2PbSO4;镍镉碱性充电电池在放电时,其正极反应为:2NiO(OH)+2H2O+2e-=2Ni(OH)2+2OH-
负极反应为:Cd+2OH--2e-=Cd(OH)2
铅蓄电池使用(放电)一段时间后,其内阻明显增大,电压却几乎不变,此时只有充电才能继续使用。镍镉碱性充电电池使用(放电)到后期,当电压明显下降时,其内阻却几乎不变,此时充电后也能继续使用。回答下列问题:
(1)铅蓄电池在放电时的负极反应为,其在充电时阳极反应为;
(2)镍镉碱性充电电池在充电时的总反应的化学方程式为;
(3)上述两种电池使用一段时间后,一个内阻明显增大,而另一个内阻却几乎不变的主要原因可能是;
(4)如果铅蓄电池在放电时回路中有2mol电子转移时,消耗H2SO4mol。
Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。 (1)该电池的负极材料是 。电池工作时,电子流向 (填“正极”或“负极”)。
(1)该电池的负极材料是 。电池工作时,电子流向 (填“正极”或“负极”)。 (2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是
(2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是
_______________。欲除去Cu2+,最好选用下列试剂中的 (填代号)。 a.NaOH b.Zn c.Fe d.NH3·H2O
a.NaOH b.Zn c.Fe d.NH3·H2O (3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是:
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是: 。若电解电路中通过2mol电子,MnO2的理论产量为 。
。若电解电路中通过2mol电子,MnO2的理论产量为 。