(6分)已知离子反应:RO+6I-+6H+===R-+3I2+3H2O,试根据离子方程式必须“质量守恒,电荷守恒”等判断:n=______________,R元素在RO3-中的化合价是______________。
由铜、锌和稀硫酸组成的原电池中: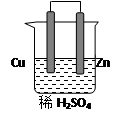
锌是极,电极反应式是。
铜是极,电极反应式是。
在铜极上可以观察到有(填实验现象)
铅蓄电池是典型的可充型电池,它的正负极是惰性材料,电池总反应式为:Pb+PbO2+4H++2SO42- 2PbSO4+2H2O。请回答下列问题:
2PbSO4+2H2O。请回答下列问题:
(1)、放电时:正极的电极反应式是________________;正极区PH值将________(填“变大”“变小”“不变”);电解液中H2SO4的浓度将变________;当外电路通过1mol电子时,理论上负极板的质量增加________g。
(2)、在完全放电耗尽PbO2和Pb时,若按图连接,电解一段时间后,则在A电极上生成________,B电极上生成________,此时铅蓄电池的正负极的极性将________。
(3)、某同学用碳棒、铜棒和稀硫酸为原材料,实现了在通常条件下不能发生的反应:
Cu+H2SO4(稀)=CuSO4+H2↑。
请在方框中画出能够实现这一反应的装置图。
化学学习中有很多形如“A+B→C+D”的反应,请根据不同的情况回答下列问题:
(1)如果上式中A、B、C、D均为多核10电子微粒,其中A为阳离子,B为阴离子,C、D均为分子,且C的相对分子质量比D大1。则:
①A+B→C+D表示的离子方程式为。
②标准状况下,若2.24L的D被50mL 1mol/L硫酸吸收,则所得溶液中各离子浓度从大到小的顺序为____。
(2)如果上式中A、C为生活中常见的金属单质,B、D为两种氧化物且它们的摩尔质量比为12:17,其中D能与NaOH溶液反应。则:
①A+B→C+D表示的化学方程式为。
②D与NaOH溶液反应的化学方程式为___。
③若将B溶于盐酸后,再加入足量NaOH溶液可观察到的现象为。
氮是地球上含量丰富的一种元素,氮元素的单质及其化合物在工农业生产、生活中有着重要作用。
(1)根据右侧能量变化示意图,请写出NO2和CO反应的热化学方程式。
(2)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g) 2NH3(g)△H < 0,其平衡常数K与温度T的关系如下表:
2NH3(g)△H < 0,其平衡常数K与温度T的关系如下表:
| T/K |
298 |
398 |
498 |
| 平衡常数K |
4.1×106 |
K1 |
K2 |
①该反应的平衡常数表达式:K=
②试判断K1K2(填写“>”,“=”或“<”)
③下列各项能说明该反应已达到平衡状态的是(填字母)
a.容器内N2、H2、NH3的浓度之比为1∶3∶2 b.v(N2)正 = 3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
(3)对反应N2O4(g) 2NO2(g)△H > 0 ,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示,下列说法正确的是。
2NO2(g)△H > 0 ,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示,下列说法正确的是。
a.A、C两点的反应速率:A>C
b.A、C两点的化学平衡常数:A>C
c.A、C两点N2O4的转化率:A>C
d.由状态B到状态A,可以用加热的方法
(4)一定温度下,在1L密闭容器中充入1molN2和3molH2并发生反应。若容器容积恒定,10min达到平衡时,气体的总物质的量为原来的7/8,则N2的转化率a(N2)=,以NH3表示该过程的反应速率v(NH3)= 。
(5)实验室制取氨气的化学反应方程式 .
Ⅰ.食品保鲜膜按材质分为聚乙烯(PE)、聚氯乙烯(PVC)、聚偏二氯乙烯(PVDC),PE和PVDC是安全的。PVC被广泛地用于食品、蔬菜外包装,它对人体的潜在危害主要来源于两个方面。一是产品中氯乙烯单体残留量(氯乙烯对人体的安全限量标准为小于1 mg/kg),二是加工过程中使用的加工助剂的种类及含量。现行国际标准和我国国家标准都允许限量使用己二酸二辛酯(即DOA)作为增塑剂(不超过35%)。化学工作者和广大消费者十分关注聚氯乙烯(PVC)保鲜膜的安全问题。PVC保鲜膜的安全隐患主要来自于塑料中残留的PVC单体以及不符合国家标准的增塑剂DEHA。
(1)工业上用乙烯和氯气为原料经下列各步反应合成PVC:
乙是PVC的单体,其结构简式为,反应②的反应类型是 ____
(2)邻苯二甲酸二辛酯(DOP)是国家标准中允许使用的增塑剂之一,邻苯二甲酸酐( )是制造DOP的原料,它跟过量的甲醇反应能得到另一种增塑剂 DMP(分子式为C10H10O4),DMP属于芳香酸酯,其结构简式为。
)是制造DOP的原料,它跟过量的甲醇反应能得到另一种增塑剂 DMP(分子式为C10H10O4),DMP属于芳香酸酯,其结构简式为。
(3)在适当的条件下,DMP经反应可得到芳香族化合物A(C8H6O4),1mol A与足量的NaHCO3溶液反应可放出CO2气体44.8L(标准状况下),1mol A在一定条件下和1 mol B反应生成 1 mol C和2 mol H2O,C的分子式为C10H8O4,请写出A和B反应的化学方程式___________________。
(4)A的同分异构体有很多,请写出任意一种既属于羧酸又属于酯的芳香族化合物的结构简式::;
Ⅱ.某可降解塑料的单体为D,经测定D的相对分子质量在90~120之间,其中含碳的质量分数为46.2%,含氢的质量分数为7.7%,其余为氧。请回答下列问题:
(1)D的分子式为。
(2)1molD与足量NaHCO3反应得到22.4L(标准状况下)CO2,与足量金属钠反应,得到22.4L(标准状况下)H2。则D分子中含有的官能团的名称为
(3)在一定条件下,D可发生反应生成五元环,则D的结构简式为。
(4)一定条件下D聚合成可降解塑料的化学方程式为。