由铜、锌和稀硫酸组成的原电池中: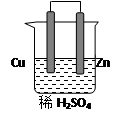
锌是 极,电极反应式是 。
铜是 极,电极反应式是 。
在铜极上可以观察到有 (填实验现象)
下图所表示的是中学化学中一类常见的物质转化关系(反应生成的H2O均略去),试按要求回答问题:
(1)若A为空气中含量最多的单质,C为一种红棕色的气体,则B与X的反应方程式为
(2)若A为有臭鸡蛋气味的气体,C为H2SO3的酸酐,则B为:,1molA与a molX充分燃烧,若要求既生成B又生成C,则a的取值范围为
氯水中存在的分子有:和H2O,离子有:和极微量的OH-,向其中滴加几滴石蕊,溶液先变红,后褪色的原因是:
试写出下列反应的化学方程式并描述主要实验现象:
(1)氢气在氯气中点燃:,现象:
(2)分别蘸有浓氨水与浓盐酸的玻璃棒相互靠近:,现象:
已知有以下物质相互转化
试回答:(1)写出B的化学式D的化学式
E的化学式H的化学式。
(2)写出由F变成G的离子反应方程式。
用给定的化学用语回答下列问题(填写化学用语的代号:A、B…)
A.过滤 B. 结晶 C.萃取 D、丁达尔效应 E、分液 F、蒸馏
结晶 C.萃取 D、丁达尔效应 E、分液 F、蒸馏
(1)鉴别胶体和溶液可根据。
(2)从KNO3溶液中提取KNO3,采用法。
(3)分离MnO2和水的混合物,可利用。
(4)食用花生油混有水份,可利用。