维生素和微量元素是生命基础的重要物质。如中学生每天需要补充维生素C约60 mg,微量元素碘约150 μg。 (1)维生素C又称抗坏血酸,其水溶液显酸性。向维生素C的溶液中滴加紫色石蕊溶液,溶液变 色。
(1)维生素C又称抗坏血酸,其水溶液显酸性。向维生素C的溶液中滴加紫色石蕊溶液,溶液变 色。 某同学欲探究维生素C的还原性,可选择的试剂是 (填序号)。
某同学欲探究维生素C的还原性,可选择的试剂是 (填序号)。 ①氨水、淀粉
①氨水、淀粉  ② KI溶液 ③酸性KMnO4溶液
② KI溶液 ③酸性KMnO4溶液 (2)加碘盐可预防碘缺乏症,其中加入的含碘物质是碘酸钾。碘酸钾的化学式为 (填序号)。
(2)加碘盐可预防碘缺乏症,其中加入的含碘物质是碘酸钾。碘酸钾的化学式为 (填序号)。 ① I2
① I2  ② KI ③ KIO3
② KI ③ KIO3 已知在酸性条件下,碘化钾与碘酸钾反应可生成碘单质。若用盐酸酸化的碘化钾淀粉溶液检验加碘盐中的碘酸钾,可观察到的现象是 。
已知在酸性条件下,碘化钾与碘酸钾反应可生成碘单质。若用盐酸酸化的碘化钾淀粉溶液检验加碘盐中的碘酸钾,可观察到的现象是 。
已知元素的某种性质“X”和原子半径、金属性、非金属性等一样,也是元素的一种基本性质。下面给出13种元素的X的数值:
| 元素 |
Al |
B |
Be |
C |
Cl[ |
F |
Li |
| X的数值 |
1.5 |
2.0 |
1.5 |
2.5 |
2.8 |
4.0 |
1.0 |
| 元素 |
Mg |
Na |
O |
P |
S |
Si |
|
| X的数值 |
1.2 |
0.9 |
3.5 |
2.1 |
2.5 |
1.7 |
试结合元素周期律知识完成下列问题:
(1)经验规律告诉我们:当形成化学键的两原子相应元素的X差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中的化学键类型是______。
(2)根据上表给出的数据,简述主族元素的X的数值大小与元素的金属性或非金属性强弱之间的关系______________________________;简述第二周期元素(除惰性气体外)的X的数值大小与原子半径之间的关系_____________________________________________。
(3)请你预测Br与I元素的X数值的大小关系________。
(4)某有机化合物分子中含有S—N键,你认为该共用电子对偏向于________原子(填元素符号)。
1994年度诺贝尔化学奖授予为研究臭氧作出特殊贡献的化学家。O3能吸收有害紫外线,保护人类赖以生存的空间。O3分子的结构如下图所示,呈V型,键角116.5℃。三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电 子,旁边两个O原子各提供1个电子,构成一个特殊的化学键——三个O原子均等地享有这4个电子。请回答:
子,旁边两个O原子各提供1个电子,构成一个特殊的化学键——三个O原子均等地享有这4个电子。请回答:
 |
| O3的分子结构 |
(1)臭氧与氧气的关系是___________。
(2)选出下列分子与O3分子的结构最相似的的是。
A.H2O B.CO2 C.SO2D.BeCl2
(3)分子中某原子有1对没有跟其他原子共用的价电子叫孤对电子,那么O3分子有___________对孤对电子。
(4)O3分子是否为极性分子___________(是或否)。
(5)O3与O2间的转化是否为氧化还原反应___________(若否 ,请回答A小题;若是,请回答B小题)
,请回答A小题;若是,请回答B小题)
A.O3具有强氧化性,它能氧化PbS为PbSO4而O2不能,试配平:
___________PbS+___________O3——___________PbSO4+___________O2
B.O3在催化剂作用下生成1molO2转移电子数___________mol
PtCl2(NH3)2可以形成两种固体,一种为淡黄色,在水中的溶解度小,另一种为黄绿色,在水中的溶解度较大,请回答下列问题:
⑴PtCl2(NH3)2是平面正方形结构,还是四面体结构
⑵请在以下空格内画出这两种固体分子的几何构型图,
淡黄色固体:,黄绿色固体:
⑶淡黄色固体物质是由分子组成,黄绿色固体物质是由分子组成(填“极性分子”或“非极性分子”)
⑷黄绿色固体在水中溶解度比淡黄色固体大,原因是。
已知A、J为常见金属单质,常温下B为液体化合物,E是空气的主要成分之一,L是蓝色沉淀,H为红棕色气体;它们之间的转换关系如下图所示: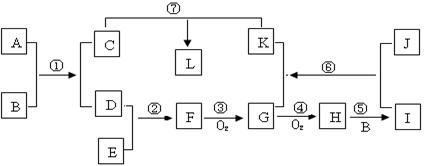
(1)H的化学式是________。
(2)③的化学方程式是__________________________________。
(3)⑥的离子方程式是_______________________________。
(4)F名称是________,检验此气体的方法是___________________________________。
用一种试剂除去下列物质中的杂质(括号内物质为杂质,所用试剂均为适量),写出所加的试剂(或所用方法)及有关反应方程式。
(1) N aCl溶液(NaHCO3):试剂,离子方程式;
aCl溶液(NaHCO3):试剂,离子方程式;
(2) MgO (Al2O3):试剂,离子方程式;
(3)Na2CO3粉末(NaHCO3):用的方法,化学方程式。