图表法、图象法是常用的科学研究方法。
下表列出前20号元素中的某些元素性质的一些数据:
| 元素 性质 |
A |
B[ |
C |
D |
E |
F |
G |
H |
I |
J |
| 原子半径(10-10m) |
1.02 |
2.27 |
0.74 |
1.43 |
0.77 |
1.10 |
0.99 |
1.86 |
0.75 |
1.17 |
| 最高价态 |
+6 |
+1 |
— |
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
+4 |
| 最低价态 |
-2 |
— |
-2 |
— |
-4 |
-3 |
-1 |
— |
-3 |
-4 |
试回答下列问题:
(1)已知H为Na元素,则以上10种元素中第一电离能最小的是: (填编号)。比元素B原子序数大10的元素其基态原子的核外电子排布是  。
。
(2)由上述C、E、G三种元素中的某两种元素形成的化合物中,每个原子的最外层都满足8电子稳定结构的可能是 (写分子式,写出一种即可),元素G、I分别和J形成的两种化合物的晶体类型分别是 。
(3)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子。其一分子中共形
成 个σ键, 个π键。
个σ键, 个π键。
(4)短周期某主族元素K的电离能情况如图(A)所示。
则K元素位于周期表的第 族。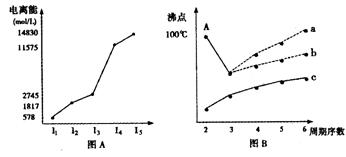
图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第 族元素氢化物的沸点的变化规律。
不同同学对某主族元素的氢化物的沸点的变化趋势画出了两条折线—折线a和折线b,你认为正确的是 ,理由是
(08济南四月调研,29)氯化铜晶体中常含FeC1杂质,为制得纯净氯化铜晶体(CuC12·2H2O),首先将其溶于稀盐酸中,然后按下面所示操作步骤进行提纯。
已知:
| 氢氧化物开始沉淀时的pH |
氯氧化物沉淀完全时的pH |
|
| Fe3+ |
1.9 |
3.2 |
| Cu2+ |
4.7 |
6.7 |
(1)下列物质中,最适合作为氧化剂X的是 (填序号)
| A.H2O2 | B.KMnO4 | C.NaC1O | D.浓硫酸 |
写出加入X后发生反应离子的方程式 。
(2)加入的物质Y可以是 ,目的是
。
|
|
(08年江苏苏州等四市教学调查,21)电浮选凝聚法是工业上采用的一种处理污水方法,右下图是电解污水实验装置示意图。接通直流电源后一段时间,在A电极附近有深色沉淀物沉积下来,在B电极附近有气泡产生。气泡可将污水中的悬浮物带到水面形成浮渣层,积累到一定厚度时刮去(或撇掉)浮渣层,即起到了浮选净化的作用。
试根据以上实验现象以及图示回答下列问题:
(1)电解池的电极A、B极性分别为 极和 极;
(2)B电极材料的物质X的名称可以是 或 ;
(3)因深色沉淀具有 性,因而可以将水中的污物沉积下来。
(4)写出A电极附近可能发生反应的电极反应式和离子方程式:
(5)若污水导电性不良时,可以加入适量 溶液(写某盐的化学式)。
如图所示,在一条鱼、虾几乎绝迹的小河边,从上游到下游依次有甲、乙、丙、丁四座工厂,各厂排放的废水里都只含有Na2CO3、FeCl3、Ca(OH)2、HCl中的一种。某中学环保小组对河水监测时发现:①甲处河水呈乳白色;②乙处河水呈红褐色;③丙处河水由浑变清;④丁处产生气泡,河水仍澄清。请回答:
⑴ 四座工厂排出的废水里含有的污染物分别为:
甲;乙;
丙;丁。(填化学式)
⑵ 在丁的下游M处取出的河水中,肯定含有的离
子是。
⑶ 写出有关反应的离子方程式:。
⑷ 小河中鱼、虾几乎绝迹的原因是。
当前,一次性筷子、一次性饭盒的安全也受到社会的关注。专家介绍说,正规的一次性筷子所用的原料都是质地较好的木材,不用特殊加工。但是很多小作坊为了降低成本,使用劣质木材,为筷子看上去白一些,他们常用硫磺进行熏蒸漂白,结果造成二氧化硫严重超标,同时硫磺中含铅、汞等重金属,也会对人体造成铅中毒或汞中毒。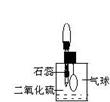

(1)“硫磺熏蒸”是应用二氧化硫的漂白性质,写出硫磺燃烧的化学方式
___________________________________________
(2)防止、减小毒筷“中毒”最简单的方法是用凉水清洗筷子表面,减少二氧化硫的含量。为研究SO2的溶解性质,某学生做如下实验:如右图,集气瓶中收集的是SO2,瓶塞系着瘪气球,向瓶中滴加紫色石蕊试液,实验现象是________。为比较SO2和CO2溶解性的大小,某学生采取同样的装置和操作,能说明SO2在水中的溶解性大于CO2在水中溶解性的实验现象是____________。某学生取出瓶中溶液,将其滴入品红溶液,充分振荡,实验现象为_______,接着向溶液中加入足量氯水,实验现象为_______,再滴加BaCl2溶液,实验现象为_____________。
(3)在制一次性筷子时有“抛光”程序:加入滑石粉和木签一起搅拌,起到干燥、打磨的作用,使筷子变得光滑,以免毛疵划人的口腔。已知滑石粉是一种含水的具有层状结构的硅酸盐矿物。其质量组成为MgO 31.88%,SiO2 63.37%,H2O 4.75%,其化学式为 。
(4)有的厂家用石蜡代替“滑石粉抛光”,石蜡是含碳原子数(C20~C30)较多的稠环芳香烃,常温下为固体,温度高时熔化后可随食物进入人体致使慢性中毒。有如右的一系列物质,则A的分子式为 ,A、B、C可以互称同系物吗?为什么?_____________?该系列化合物里碳的最大质量分数为 ? 若E是A的一个氢原子被羟基取代的产物,预测E可能具有哪些化学性质(至少举2条)
|
中央电视台新闻栏目2006年5月14日报道齐齐哈尔第二制药有限公司生产的假药事件, “齐二药”违反规定,购入工业用“二甘醇”代替医用丙二醇(C3H8O2)作辅料,用于“亮菌甲素注射液”的生产,导致多名患者肾功能衰歇,造成多名患者死亡。二甘醇又称乙二醇醚,分子式为C4H10O3(HO-CH2-CH2-O-CH2-CH2-OH),二甘醇是一种重要的化工原料,可以制取酸、酯、胺等,其主要产品有吗啉及其衍生物1,4-二恶烷( )等被广泛应用于石油化工、橡胶、塑料、制药等行业,用途十分广泛。二甘醇一般的合成路线为:
)等被广泛应用于石油化工、橡胶、塑料、制药等行业,用途十分广泛。二甘醇一般的合成路线为:
 |
 |

|
过程Ⅰ Br2条件Ⅱ反应Ⅲ