中药莲花清瘟胶囊是治疗甲型H1N1流感的有效药物,连翘是其主要成分之一,芳香族化合物X是合成连翘的有效成分连翘酯苷的中间体。
已知:
①X的相对分子质量180,碳的质量分数为60%,氢为4.45 %,其余为氧;
%,其余为氧;
②1mol X最多能与3mol NaOH反应,且X能与NaHCO3反应产生CO2气体;
③X遇FeCl3发生显色反应;
④经红外光谱分析X分子中含有碳碳双键。
请回答下列问题:
(1)X的分子式为 ,X中含有的官能团除碳碳双键外,还含有: 。
(2)X分子中苯环上有三个取代基,其中两个相同的取代基相邻,与另一种取代基不相邻,核磁共振氢谱表明有8种氢原子,则其结构简式为 。
(3)X与足量的浓溴水反应的化学方程式为 。
(4)有机物Y与X互为同分异构体,请写出符合下列条件的Y结构简式 。
①Y的苯环上有三个互不相邻的取代基,遇FeCl3不发生显色反应,不与NaHCO3反应,但能与Na反应生成H2;
②1mol Y最多能与4mol Ag(NH3)2OH发生银镜反应;
③在一定条件下,1mol Y最多与2mol  NaOH反应。
NaOH反应。
阿明洛芬属于苯丙酸类抗炎药,镇痛效果优于布洛芬。下图是阿明洛芬的一条合成路线。
⑴反应①为取代反应,该步反应物Me2SO4中的“Me”表示。
⑵E中的官能团有:(写名称)。
⑶写出反应类型:④。
⑷写出F的结构简式。
⑸反应③可以看成是两步反应的总反应,第一步是氰基(—CN)的完全水解反应生成羧基(—COOH), 请写出第二步反应的化学方程式。
⑹化合物 是合成某些药物的中间体。试设计合理方案由化合物
是合成某些药物的中间体。试设计合理方案由化合物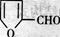 合成
合成 。
。
①合成过程中无机试剂任选;
②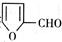 在400摄氏度金属氧化物条件下能发生脱羰基反应;
在400摄氏度金属氧化物条件下能发生脱羰基反应;
③CH2=CH-CH=CH2与溴水的加成以1,4-加成为主;
④合成反应流程图表示方法示例如下:
2010年上海世博会场馆,大量的照明材料或屏幕都使用了发光二极管(LED)。目前市售LED品片,材质基本以GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、lnGaN(氮化铟镓)为主。已知镓是铝同族下一周期的元素。砷化镓的晶胞结构如下图。试回答:
⑴镓的基态原子的电子排布式是。
⑵砷化镓晶胞中所包含的砷原子(白色球)个数为,与同一个镓原子相连的砷原子构成的空间构型为。
⑶N、P、As处于同一主族,其氢化物沸点由高到低的顺序是。 (用氢化物分子式表示)
⑷砷化镓可由(CH3)3Ga和AsH3在700℃时制得。(CH3)3Ga中镓原子的杂化方式为。
⑸比较二者的第一电离能:As______Ga(填“<”、“>”或“=”)。
⑹下列说法正确的是(填字母)。
A.砷化镓晶胞结构与NaCl相同 B.GaP与GaAs互为等电子体
C.电负性:As>GaD.砷化镓晶体中含有配位键
现代炼锌的方法可分为火法和湿法两大类,镉是生产硫酸锌的副产品,属于高毒性金属,试回答下列相关问题.
⑴火法炼锌是将闪锌矿(主要含ZnS)通过浮选、焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热至1373-1573K,使锌蒸馏出来。主要反应为:
2ZnS +3O2 2ZnO+2SO2; 鼓风炉中:2C +O2
2ZnO+2SO2; 鼓风炉中:2C +O2 2CO ZnO+CO
2CO ZnO+CO Zn + CO2
Zn + CO2
从火法炼锌蒸馏后的残渣中含多种金属单质及In2O3,可用硫酸提取铟,某研究机构对此研究数据如下。实验中涉及的酸度(每升溶液中含硫酸的质量)与铟的浸出率如下图1;硫酸溶液的体积与固体的体积比如图2
①当酸度为196时,其物质的量浓度为 。
②从节约原料和浸出率考虑,适宜的酸度和液固比分别为:_______、_______。
⑵湿法炼锌的主要工艺流程为:
①从保护环境和充分利用原料角度,如何处理或利用烟气。
②除去酸浸出液中的铁,可用H2O2氧化,再调节pH使之形成Fe(OH)3沉淀,写出H2O2氧化Fe2+的离子方程式。
③酸浸出液还含有Cd2+,为了防止镉污染并回收镉,根据它们性质的差异,可用氢氧化钠溶液分离,已知Zn(OH)2和氢氧化铝一样也具有两性,试写出分离的离子方程式____________________、_______________。
甲醇是一种很好的燃料,工业上用CH4和H2O为原料,通过反应Ⅰ和Ⅱ来制备甲醇。
⑴将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应:
CH4(g)+H2O(g) CO(g)+3H2(g)……Ⅰ。CH4的转化率与温度、压强的关系如上图。
CO(g)+3H2(g)……Ⅰ。CH4的转化率与温度、压强的关系如上图。
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为。
②图中的P1P2(填“<”、“>”或“=”),100℃时平衡常数为。
③该反应的△H0(填“<”、“>”或“=”)。
⑵在压强为0.1 MPa条件下,将a mol CO与 3amol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g) CH3OH(g);△H<0……Ⅱ。
CH3OH(g);△H<0……Ⅱ。
④若容器容积不变,下列措施可增加甲醇产率的是。
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1mol CO和3mol H2
⑤为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。

A.则上表中剩余的实验条件数据:a=________、b=_______。
B.根据反应Ⅱ的特点,右上图是在压强分别为0.1MPa和5MPa下CO的转化率随温度变化的曲线图,请指明图中的压强Px=_________MPa。
某校化学研究性学习小组查阅资料了解到以下内容:
乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,其熔点为101.5℃,在157℃升华。为探究草酸的部分化学性质,进行了如下实验:
⑴向盛有1 mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生。该反应的离子方程式为________________________________。
⑵向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现其溶液的紫红色褪去,说明乙二酸具有_____________(填“氧化性”、“还原性”或“酸性”),请配平该反应的离子方程式:
____ MnO4– + ____ H2C2O4 + _____ H+ =" _____" Mn2+ + _____ CO2↑ + _____ H2O
⑶将一定量的乙二酸放于试管中,按下图所示装置进行实验(夹持装置未标出):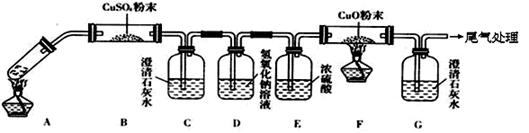
实验发现:装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末变红。据此回答:
上述装置中,D的作用是__________________。乙二酸分解的化学方程式为______________________。
⑷该小组同学将2.52 g草酸晶体(H2C2O4·2H2O)加入到100 mL 0.2 mol·L-1的NaOH溶液中充分反应,测得反应后溶液呈酸性,其原因是___________________________________(用文字简单表述)。
⑸以上溶液中各离子的浓度由大到小的顺序为:_____________________________(用离子符号表示);