有以下几种物质:①干燥的食盐晶体②冰醋酸③水银④蔗糖⑤KNO3溶液,填空回答:
(1)以上物质能导电的是
(2)以上物质中属于电解质的是
(3)以上物质中属于非电解质的是
孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuSO4·5H2O及CaCO3,步骤如下:
请回答下列问题:
(1)溶液A中的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中试剂①为________(填代号),检验溶液A中Fe3+的最佳试剂_____(填代号)。
a.KMnO4 b.(NH4)2S c.H2O2 d.KSCN
(2)由溶液C获得CuSO4·5H2O,需要经过加热蒸发、________、过滤等操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是 ________________。
(3)制备CaCO3时,应向CaCl2溶液中先通入(或先加入)________(填化学式) 。
。
(4)欲测定溶液A中Fe2+的浓度,需要用容量瓶配制某标准溶液,定容时视线应________,直到。用KMnO4标准溶液滴定时应选用________滴定管(填“酸式”或“碱式”)。
( 12 分)(1)某校化学兴趣小组用如下图所示过程除去AlCl3中含有的Mg2+、K+杂质离子并尽可能减少AlCl3的损失。请回答下列问题:
①写出混合物中加入足量氢氧化钠溶液时,溶液中发生反应的离子方程式:
。
②溶液a中存在的阴离子有__________________;在溶液a中加入盐酸时需控制溶液的pH的原因是_______________________________________;为此,改进方法是。
(2)该化学小组又测定一定质量的某镁铝混合物中镁的质量分数,设计了如下实验方案:
方案Ⅰ:镁铝混合物 测定生成气体的体积
测定生成气体的体积
方案Ⅱ:镁铝混合物 测定剩余固体的质量
测定剩余固体的质量
下列有关判断中不正确的是(填代号)
| A.溶液A选用NaOH溶液 |
| B.若溶液B选用浓硝酸,则测得镁的质量分数偏小 |
| C.溶液A和B均可选用稀硝酸 |
| D.实验室中方案Ⅱ更便于实施 |
水是生命之源,也是化学反应中的主角。试回答下列问题:
A、B、C是中学化学常见的三种有色物质(其组成的元素均属短周期元素),摩尔质量依次增大,它们均能与水发生氧化还原反应,但水既不是氧化剂也不是还原剂,请写出A、B、C与水反应的化学方程式:
A+H2O ;
B+H2O ;
C+H2O 。
A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出):
且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。请填写下列空白:
⑴A、B、C、D、E、F六种物质中所含同一种元素在周期表中位置。
⑵写出C、G物质的化学式,C______________ G______________
⑶写出①、④、⑥反应的化学方程式。
反应①
反应④
反应⑥
⑷写出A与水蒸气反应的化学方程式
在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中发生反应:N2O4 (g)  2NO2 (g) △H> 0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化关系如下图所示。
2NO2 (g) △H> 0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化关系如下图所示。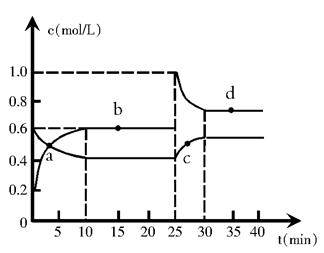
(1)该温度时,该反应的平衡常数为________________, 若温度升高,K值将__________(填“增大”、“减小”或“不变”)。
(2)a、b、c、d四个点中,化学反应处于平衡状态的是____________点。从起点开始首次达到平衡时,以NO2表示的平均反应速率为______________________。
(3)25 min时,增加了______mol___________(填物质的化学式)使平衡发生了移动。
(4)d点对应NO2的物质的量浓度______(填“>”、“<”或“=”)0.8mol•L-1,理由是_____________________________________________________。