在一个2L的密闭容器中,发生反应2SO3(g) 2SO2(g)+ O2(g);△H >0,其中SO3的变化如右图所示:
2SO2(g)+ O2(g);△H >0,其中SO3的变化如右图所示:

(1)写出该反应的平衡常数表达式_______________ 。
(2)用O2表示0~8min内该反应的平均速率v= 。
(3)升高温度, K值将 ;容器中气体的平均相对分子质量将 。(填“增大”“减小”或“不变”)
(4)从8min起,压缩容器为1L,则SO3的变化曲线为
| A.a | B.b | C.c | D.d |
(5)计算该温度下的平衡常数K=
(28分)
[1]由碳、氢、氧三种元素组成的某有机物分子中共含有13个原子,其原子核外共有40个电子,l mol该有机物在氧气中完全燃烧时需消耗5.5 mol O2。请回答:
(1)试求出该有机物的分子式为 。
(2)若该有机物可使溴水褪色,且分子中不含有甲基,也不能发生银镜反应,取0.1 mol该有机物与足量钠反应,能产生1.12 L H2(标准状况),则该有机物的结构简式可能是 ;该有机物在一定条件下发生聚合反应的化学方程式是 。
(3)若该有机物能发生银镜反应,且分子中只含有一个甲基,则其结构简式是 。
(4)若该有机物的结构呈环状,且既不含甲基又不含羟基,则其键线式是 。
[2]2006年5月,齐齐哈尔第二制药厂生产的假药“亮菌甲素注射液”导致多名患者肾功能衰竭。“亮菌甲素”的结构简式为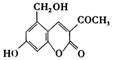 ,它配以辅料丙二
,它配以辅料丙二
|
醇溶成针剂用于临床。假药中使用廉价的二甘醇作为辅料,二甘醇为工业溶剂,有很强的毒性。请回答下列问题:
(1)“亮菌甲素”的分子式为 。从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取两种工艺品的流程如下:
请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的方程式为。
(2)流程乙加入烧碱后生成SiO32-的离子方程式为。
(3)验证滤液B含Fe3+,可取少量滤液并加入(填试剂名称)。
(4)滤液E中溶质的主要成份是(填化学式),写出该物质的一种具体用途。
(5)已知298 K时,Mg(OH)2的容度积常数Ksp=5.6×10-12,取适量的滤液B,加入一定量的烧碱达到沉淀溶液平衡,测得pH=13.00,则此温度下残留在溶液中的c(Mg2+) =。
提示:某些金属氧化物跟熔融烧碱反应可生成盐。根据以下化学反应框图填空: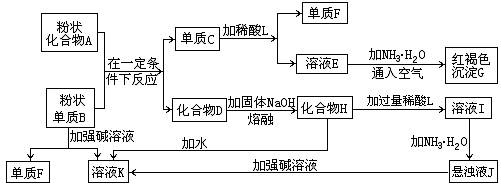
(1)单质F是_____________________。
(2)由E生成G的离子反应方程式(或化学方程式)________________________。
(3)溶液I中所含金属离子是_____________________。
(4)由C转化为E、F若改用浓酸,则不能选用的浓酸是(写分子式)______________。
A、C、E是中学化学中常见的单质,A是固体,C、E是无色无味的气体,D是黑色晶体,它们之间的转化关系如下图所示。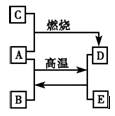
(1)写出A、B、C的化学式:
A___________________;B_________________;C______________。
(2)写出A、B转化为D、E的化学方程式_____________________________________。
(3)写出A与足量稀硝酸反应的离子方程式___________________________________。
若把Fe3O4看成“混合氧化物”时可以写成FeO•Fe2O3,若看成一种盐时又可以写成Fe(FeO2)2。根据化合价规则和这种书写方法,Pb3O4可以分别写作
和。等物质的量的Fe3O4和Pb3O4分别和浓盐酸反应时,所消耗HCl的物质的量相等,不同的是,高价的铅能将HCl氧化而放出氯气。试写出Fe3O4、Pb3O4分别和浓盐酸反应的化学方程式,
。