实验室可用KMnO4和浓盐酸反应制取氯气。其变化可表述为:
( )KMnO4+( )HCl(浓) ===( )KCl+( )MnCl2+( )Cl2↑+( )H2O
(1)请配平化学方程式(将化学计量数填入括号内)。
(2)请将上述配平的化学方程式改写为离子方程式________________。
(3)浓盐酸在反应中显示出来的性质是________________(填写编号,多选倒扣)。
①只有还原性 ②还原性和酸性
③只有氧化性 ④氧化性和酸性
(4)产生0.5molCl2,则转移的电子的物质的量为______mol。
(5)已知反应CuS+4HNO3=Cu(NO3)2+2NO2↑+S↓+2H2O,当转移电子数为1.806×1023时,被还原的硝酸的物质的量是 ,产生标况NO2的体积为 。
已知A、B、C、D为气体,E、F为固体,G为CaCl2,它们之间的转化关系如下: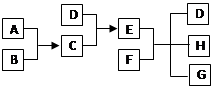
(1)D的结构式为, E的电子式为。
(2)用电子式表示A和B反应形成C的过程。
(3)E和F反应生成D、H和G的化学方程式,该反应的用途是。
向200mL 6mol·L-1盐酸中加入一定量的纯净CaCO3,产生气体的体积随时间的变化曲线如图所示(气体体积均在标准状况下测定)。
请回答下列问题:
(1)设OE段的反应速率为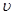 1,EF段的反应速率为
1,EF段的反应速率为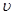 2,FG段的反应速率为
2,FG段的反应速率为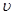 3,则
3,则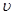 1、
1、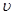 2、
2、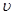 3从大到小的顺序为。
3从大到小的顺序为。
(2)为了减缓上述反应的速率,欲向该溶液中加入下列物质,你认为可行的是(填字母)。
| A.蒸馏水 | B.氯化钾固体 |
| C.氯化钠溶液 | D.浓盐酸 |
(3)加入CaCO3的质量为。
(4)若反应过程中溶液体积的变化忽略不计,则EF段用盐酸表示的化学反应速率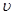 (HCl)=。
(HCl)=。
A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A与D同主族;C与E同主族;B、C同周期;B原子最外层电子数比其次外层电子数多2;A是周期表中半径最小的元素,C的最外层电子数是内层电子的3倍;F元素是同周期元素中原子半径最小的主族元素。A、B、C、D、E形成的化合物甲、乙、丙、丁的组成如下表所示:
| 化合物 |
甲 |
乙 |
丙 |
丁 |
| 化学式 |
A2C |
A2C2 |
D2C2 |
D2E |
回答下列问题:
(1)写出下列元素名称:A;指出元素F在周期表中的位置的。
(2)化合物乙的电子式为,用电子式表示形成化合物丁的过程。
(3)写出丙与甲反应的化学方程式:
(4)固体氧化物燃料电池是以固体氧化锆—氧
化钇为电解质,这种固体电解质在高温下允
许O2-在其间通过,该电池的工作原理如下图所示,其中多孔Pt电极a、b分别是气体C2、A2的载体。①该电池的负极为(填a或b);O2-流向极(填“正极”或“负极”)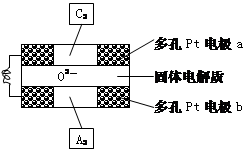
②该电池的正极反应为,
负极反应为。
(一)、下列各项分别与哪个影响化学反应速率的因素的关系最为密切?
(1)硫在氧气中比在空气中燃烧剧烈
(2)MnO2加入双氧水中反应更剧烈
(3)同质量的铁片和铁粉与足量的同浓度的盐酸反应,后者先反应完
(4)镁粉在冷水中反应仅有微量气泡逸出,但加热时则有大量气泡产生
(二)、氮化硅是一种新型陶瓷材料,它可由石英晶体与焦炭颗粒在高温的氮气流中,通过如下反应制得:3SiO2 + 6C + 2N2 Si3N4 + 6CO,该反应过程中的能量变化如图所示;回答下列问题:
Si3N4 + 6CO,该反应过程中的能量变化如图所示;回答下列问题: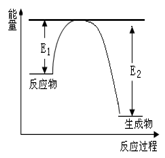
(1)上述反应中的还原剂是,还原产物是。
(2)若反应中测得生成4.48 L CO气体(标准状况下),则转移的电子数为。
(3)该反应是(填“吸热”或“放热”)反应。
(三)、在一定温度下,4L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图所示: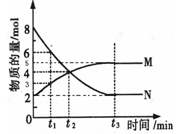
(1)写出该反应的化学方程式为。
(2)比较t2时刻,正逆反应速率大小 (正)
(正) (逆)。(填“>”、“=”、“<”)。.
(逆)。(填“>”、“=”、“<”)。.
(3)若t2=2min,计算反应开始至t2时刻,M的平均化学反应速率为。
(4)t3时刻化学反应达到平衡时反应物的转化率为。
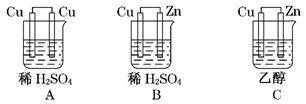
根据右图化学电池装置,回答下列问题: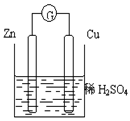
(1)负极发生的反应式为,
观察到得现象是。
(2)正极材料是,电极反应为,观察到得现象是。
(3)该装置的能量转化:。
(4)该装置中电子流向:→电流表→。
(5)在下图所示的装置中,能够发生原电池反应的是。