(12分)实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH+6HCHO===3H++6H2O+(CH2)6N4H+[滴定时,1 mol(CH2)6N4H+与1 mol H+相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ 称取样品1.500 g。
步骤Ⅱ 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤Ⅲ 移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数________(填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积________(填“偏大”、“偏小”或“无影响”)。
③滴定时边滴边摇动锥形瓶,眼睛应观察______ _ 。
A.滴定管内液面的变化
B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由______________ 色变成____________色。
色变成____________色。
(2)滴定结果如下表所示:
| 滴定次数 |
待测溶液的体积/mL |
标准溶液的体积 |
|
| 滴定前刻度/mL |
滴定后刻度/mL |
||
| 1 |
25.00 |
1.02 |
21.03 |
| 2 |
25.00 |
2.00 |
21.99 |
| 3 |
25.00 |
0.20 |
20.20 |
若NaOH标准溶液的浓度为0.101 0 mol/L,则该样品中氮的质量分数为________。
某文献中指出“氯化铝、氯化锡为共价化合物”。请你设计一个实验证实其结论的正确性。
如图3-28表示一些晶体中的某些结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨结构中的某一种的某一部分。
图3-28
(1)代表金刚石的是(填编号字母,下同) __________,其中每个碳原子与__________个碳原子最接近且距离相等。金刚石属于__________晶体。
(2)代表石墨的是__________,其中每个正六边形占有的碳原子数平均为__________个。
(3)代表NaCl的是__________,每个Na+周围与它最接近且距离相等的Na+有__________个。
(4)代表CsCl的是__________,它属于__________晶体,每个Cs+与__________个Cl-紧邻。
(5)代表干冰的是__________,它属于__________晶体,每个CO2分子与__________个CO2分子紧邻。
(6)若说“离子晶体中只有离子键,分子晶体中没有化学键”是否正确?简答理由。
(7)NaCl晶体、HCl晶体、干冰、金刚石熔点由高而低的顺序是__________;其中在熔融或液态时能导电的电解质是__________,液态不导电但为电解质的是__________,在水溶液中能导电的非电解质是__________。
(12分)随着科学技术的发展,阿伏加德罗常数的测定手段越来越多,测定精确度也越来越高,现有一种简单可行的测定方法,具体步骤为: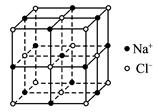
(1)将固体NaCl研细、干燥后,准确称取m g NaCl固体并转移到定容仪器A中。
(2)用滴定管向A仪器中滴加苯,不断振荡,继续加苯至A仪器的刻度线,计算出NaCl固体的体积为V cm3。
①步骤(1)中A仪器最好用________________ (仪器名称)。
②步骤(2)中用酸式滴定管好还是碱式滴定管好,________________________________,理由是____________________________________________________________________________。
③能否用胶头滴管代替步骤(2)中的滴定管;理由是_________________________________。
④已知NaCl晶体的结构如上图所示,用X射线测得NaCl晶体中靠得最近的Na+与Cl-间的平均距离为a cm,则用上述测定方法测得阿伏加德罗常数NA的表达式为NA=__________。
用如图所示装置进行实验。完成有关问题: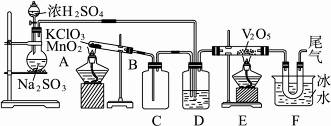
(1)玻璃管E内发生反应的化学方程式为________________。
(2)C的作用是________________。
(3)广口瓶D内盛的试剂是________,此装置的3个主要作用是________________。
(4)从试管E导出的气体成分是________________。
(5)装置F中U形管观察到所收集的物质的颜色状态是________________。
(6)该实验还缺少一个________装置。
如图所示为实验室制SO2并验证SO2的某些性质的装置图。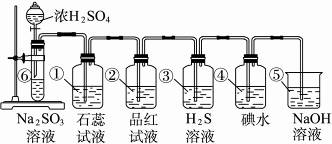
试完成下列问题:
(1)⑥中反应的化学方程式为_____________。
(2)①中的实验现象为_____________,此实验证明SO2是_____________气体。
(3)②中的品红溶液_____________,证明SO2有_____________性。
(4)③中的实验现象是_____________,证明SO2有_____________性。
(5)④中的实验现象是_____________,证明SO2有_____________性。
(6)⑤的作用是_____________,反应的化学方程式是__________________________。