有可逆反应:Fe(s)+CO2(g)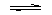 FeO(s)+CO(g)。已知938K时平衡常数K=1.47,1173K时平衡常数K=2.15。
FeO(s)+CO(g)。已知938K时平衡常数K=1.47,1173K时平衡常数K=2.15。
(1)该反应的平衡常数表达式____________________,是____________(填“吸热”或“放热”)反应。
(2)若该反应在体积恒定的密闭容器中进行,在一定条件下达到平衡状态,如果改变下列条件,反应混合气体的平均相对分子质量如何变化(填“增大”、“减小”或“不变”)。
①升高温度_________________;②再通入CO__________________。
(3)该反应的逆反应速率随时间变化的关系如图: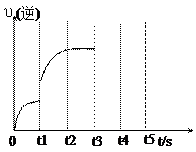
 ①从图中可以看出,反应t2时达到平衡,在
①从图中可以看出,反应t2时达到平衡,在
t1时改变某种条件,该条件可能是_______。
A.升高温度
B.增大CO2浓度
C.使用催化剂
②如果在t3时从混合物中分离出部分CO,t4~t5时间段反应处于新的平衡状态,请在图上
画出t3~t5的υ(逆)变化曲线。
(27分)(1)现有如下两个反应:①NaOH + HCl =" NaCl" + H2O;②Fe +H2SO4 = FeSO4 + H2 ↑
两反应中为放热反应的是,能设计成原电池的是。(填序号)
(2)根据下图填空①电子从片流出,溶液中H+向片移动。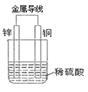
② 正极的现象是,发生反应(填写“氧化”或“还原”)。
③负极的电极方程式为
④ 若反应过程中有0.01mol电子发生转移,则生成的氢气在标准状况下的体积为L。
(3)写出电解氯化铜溶液时,阴极的电极反应方程式:。
把0.04 mol X气体和0.06 mol Y气体混合于2 L密闭容器中,使它们发生如下反应:4X(g)+5Y(g)===nZ(g)+6W(g);2 min末生成0.03 mol W。若测知以Z的浓度变化表示的反应速率为0.005 mol·(L·min)-1。试计算:
(1)前2 min内用X的浓度变化表示的平均反应速率为 ;
(2)化学方程式中n的值是 。
在一容积为2 L的密闭容器内加入0.2 molA和0.6 molB,在一定条件下发生反应:A(s)+3B(g) 2C(s)+3D(g) 已知该反应在不同温度下的平衡常数如下表:
2C(s)+3D(g) 已知该反应在不同温度下的平衡常数如下表:
| 温度/℃ |
1000 |
1150 |
1300 |
| 平衡常数 |
64.0 |
50.7 |
42.9 |
请回答下列问题:
⑴该反应的平衡常数表达式K=,ΔH0(填“>”或“<”)。
⑵1000 ℃时,4 min后达到平衡.求4 min内D的平均反应速率v(D)=,B的平衡转化率为,平衡时B的体积分数。
⑶欲提高⑵中B的平衡转化率,可采取的措施是
A.减少C的量B.增加A的量 C.移出部分D
D.降低反应温度 E.减小容器的容积 F.加入合适的催化剂
⑷1000 ℃时, 在一容积为2 L的密闭容器内加入XmolC和0.6 molD,5 min后达到平衡,B的浓度与⑵中B的浓度相同,求X的范围
⑸下列说法中能说明反应已达到平衡状态的是
A.容器内混合气体的压强不随时间变化而变B.B的速率不随时间的变化而变化
C.c(B)︰c(D)=1︰1D.混合气体的密度保持不变(M(B)≠M(D))
常温下,某水溶液中存在的离子有:Na+、B2-、HB-、H+、OH-,存在的分子有H2O、H2B。根据题意回答下列问题:
(1)写出酸H2B的电离方程式﹑。
(2)常温下,已知0.1 mol·L-1二元酸H2B溶液中c(OH-) / c(H+)=1×10-6。
①常温下,0.1 mol·L-1H2B溶液的pH=;
②写出该酸(H2B)与少量NaOH溶液反应的离子方程式:;
(3)常温下,将100 mL 0.1 mol·L-1的稀H2SO4溶液与100 mL 0.4 mol·L-1的NaOH溶液充分混合(溶液体积变化忽略不计),所得溶液的pH=。
(4)t℃时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数Kw=。该温度下(t℃),0.1 mol·L-1HCl溶液的pH=;
⑴有下列物质:①铜 ②硫酸钡固体 ③氨水 ④氢氧化钠固体 ⑤熔融硝酸钾;⑥乙醇; ⑦稀硫酸; ⑧金刚石; ⑨二氧化硫 ; ⑩冰醋酸。
其中能导电的有;属于非电解质的有;属于强电解质的有;(填序号)
⑵常温下,将pH=3的盐酸和pH=11的氨水等体积混合后溶液呈性,溶液中c(NH4+)与c(Cl-)的大小关系是:c(NH4+)c(Cl-);
⑶常温下,0.010mol·L-1盐酸和0.010mol·L-1氨水的pH之和14,常温下,pH=2的盐酸和pH=12的氨水,分别加水稀释10倍后,两溶液的pH之和14(填>,<或=)
⑷用物质的量浓度为0.04 mol·L-1的盐酸恰好中和OH-浓度为1.0×10-3 mol·L-1的氨水溶液20mL,消耗盐酸12.5mL,则此氨水物质的量浓度为mol·L-1;电离度为。