(14分)透明聚酯玻璃钢可用于制造导弹的雷达罩和宇航员使用的氧气瓶。制备它的一种配方中含有下列四种物质: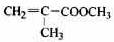
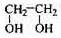


(甲) (乙) (丙 ) (丁)
) (丁)
填写下列空白:
(1)甲中不含氧原子的官能团是___________________;下列试剂能与甲反应而褪色的是___________(填标号)
a. Br2/CCl4溶液 b.石蕊溶液 c.酸性KMnO4溶液
(2)甲的同分异构体有多种,写出其中一种不含甲基的羧酸的结构简式:_______
(3)淀粉通过下列转化可以得到乙(其中A—D均为有机物):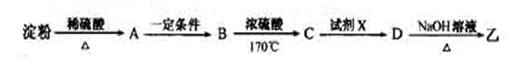
B的分子式是___________,试剂X可以是___________。
(4)已知: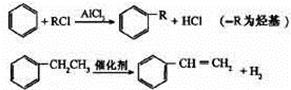
利用上述信息,以苯、乙烯、氯化氢为原料经三步反应合成丙,其中属于取代反应的化学方程式是 。
(5)化合物丁仅含碳、氢、氧三种元素,相对分子质量为110。丁与FeCl3溶液作用显现特征颜色,且丁分子中烃基上的一氯取代物只有一种。则丁的结构简式为 。
(8分)下图为一“铁链”图案,小明在图案上由左到右分别写了H2、CO2、Na2O、NaCl、FeCl3五种物质,图中相连的两种物质均可归属为一类,相交部分由左到右A、B、C、D为其相应的分类依据代号。
请回答下列问题:
(1)请将分类依据代号填入相应的括号内:
( )两种物质都是气体
( )两种物质都是钠的化合物
( )两种物质都是氧化物
( )两种物质都是盐
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入饱和的上图中某种物质M的水溶液,继续煮沸可制得一种红褐色胶体。
①物质M的化学式为____________。
②证明有红褐色胶体生成的实验操作是____________________________________
(12分)已知反应:①SO3+H2O===H2SO4、②3NO2+H2O===2HNO3+NO
③2F2+2H2O===4HF+O2、④2Na+2H2O===2NaOH+H2↑、
⑤Na2O+2HCl===2NaCl+H2O、⑥SiO2+2NaOH===Na2SiO3+H2O
(1)上述反应中不属于氧化还原反应的有______________________ (填序号,下同).
H2O被氧化的是______,H2O被还原的是______.属于氧化还原反应,但其中的H2O既不被氧化又不被还原的是__________________.
(2) 用双线桥分析反应②:______________________________________________.
(3) 用单线桥标出反应③的电子转移方向和数目_________________________.
(4)写出反应④的离子方程式:______________________________________________.
(6分)有以下几种物质①干燥的食盐晶体 ②液态氯化氢 ③水银 ④蔗糖 ⑤纯硫酸 ⑥KNO3溶液填空回答:(填序号)
(1)以上物质能导电的是____________
(2)以上物质中属于电解质的是____________ 。
(3)以上物质中属于非电解质的是____________ 。
硫酸盐有着广泛的应用。
(1)以下是CuSO4·5H2O的实验室制备流程图。
根据题意完成下列填空:
① 理论上,为了制得纯净的CuSO4·5H2O晶体,需要消耗稀硫酸、稀硝酸溶质物质的量之比为,发生反应的离子方程式为。
② 实际生产过程中对所加稀硝酸的浓度控制要求比较高,通常用标准氢氧化钠溶液来滴定。滴定过程中若用酚酞作指示剂,终点现象是。请在下图中画出滴定过程中溶液的pH随所滴加氢氧化钠溶液体积的变化的曲线图(要求过A点)。
③用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1mol Cu2 (OH)2CO3后恰好恢复到电解前的浓度和pH(不考虑CO2的溶解)。则电解过程中共转移电子的物质的量为
(2)为测定混合肥料K2SO4、(NH4)2SO4中钾的含量,完善下列步骤:
①称取钾氮肥试样并溶于水,加入足量溶液,产生白色沉淀。
②、、(依次填写实验操作名称)。
③冷却、称重。
若试样为m g,沉淀的物质的量为n mol,则试样中K2SO4的物质的量为:mol.
(用含m、n的代数式表示)。
(3)PbSO4难溶于水却可溶于醋酸,你认为可能的原因是
①醋酸铅可溶于水 ②醋酸铅是弱电解质
③醋酸铅在水中形成电离平衡时的c(Pb2+)小于PbSO4的溶解平衡的c(Pb2+)
⑤因醋酸是弱酸,故反应可进行
现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复)。
| 阳离子 |
H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 |
OH-、C1-、CO32--、NO3-、SO42- |
已知:
①A、B两溶液呈碱性;C、D、E溶液呈酸性。
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀不包括微溶物,下同)。
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀。
试回答下列问题:
(1)将C溶液逐滴加入等体积、等物质的量的浓度的A溶液中,反应后溶液中各种离子浓度由大到小的顺序为:。
(2)已知:NaOH(aq)+HNO3(aq)= NaNO3(aq)+H2O(1) △H=-a KJ·mol-1。请写出B与C的稀溶液反应的热化学方程式。
(3)写出E溶液与过量的B溶液反应的离子方程式。
(4)在100mL0.1mol·L-1E溶液中,逐滴加入35mL 2mol·L-1NaOH溶液,最终得到的沉淀的物质的量为。