甲在常温时为离子晶体,由X、Y两种元素组成,在甲中Xm+和Yn–的电子结构相同,甲、乙、丙、丁、戊、己之间有如下反应关系:
 ①甲+H2O H2↑+乙+丙↑ ②H2 + 丙 丁(气体)
①甲+H2O H2↑+乙+丙↑ ②H2 + 丙 丁(气体)
 ③乙+丙 甲+戊+H2O ④戊+丁 甲+己(酸性)
③乙+丙 甲+戊+H2O ④戊+丁 甲+己(酸性)
甲、戊、己依次是( )
| A.NaCl、NaClO、HClO | B.Na2S、Na2SO3、H2SO3 |
| C.CaCl2、Ca(ClO)2、HClO | D.K2S、K2SO3、H2SO4 |
下列三种化合物是按强电解质、弱电解质、非电解质的顺序排列的一组是()
| A.HCl、CaCO3、SO2 | B.KNO3、CH3COOH、NH3 |
| C.HClO、H2S、C2H5OH | D.BaSO4、H3PO4、H2O |
相同温度下,体积均为1.5 L的两个恒容容器中发生可逆反应:
X2 (g+3Y2(g)  2XY3(g) ΔH=-92.6 kJ·mol-1,实验测得有关数据如下表:
2XY3(g) ΔH=-92.6 kJ·mol-1,实验测得有关数据如下表:
| 容器编号 |
起始时各物质物质的量/mol |
达平衡时体系能量的变化 |
||
| X2 |
Y2 |
XY3 |
||
| ① |
1 |
3 |
0 |
放热46.3 kJ |
| ② |
0.8 |
2.4 |
0.4 |
Q(Q>0) |
下列叙述不正确的是( )
A.容器①中达到平衡时,Y2的转化率为50%
B.Q="27.78" kJ
C.若容器①体积改为1.0 L.则达平衡时放出的热量大于46.3 kJ
D.容器①、②中反应的平衡常数相等,K=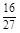
现有常温下的四份溶液:①0.01 mol/L CH3COOH溶液;②0.0l mol/L HC1溶液;③pH=12的氨水;④pH=12的NaOH溶液。下列说法正确的是( )
| A.①中水的电离程度最小,③中水的电离程度最大 |
| B.将②、③混合,若pH=7,则消耗溶液的体积:②>③ |
| C.将①、④混合,若c(CH3COO-)>c(H+),则混合液一定呈碱性 |
| D.将四份溶液分别稀释100倍后,溶液的pH:③>④,①<② |
Mg-AgCl电池是一种能被海水激活的一次性贮备电池,电池反应方程式为:
2AgCl+ Mg = Mg2++ 2Ag +2Cl-。有关该电池的说法正确的是( )
| A.Mg为电池的正极 |
| B.负极反应为AgCl+e-=Ag+Cl- |
| C.不能被KCl 溶液激活 |
| D.可用于海上应急照明供电 |
某有机物Z具有较广泛的抗菌作用,其生成机理可由X与Y相互作用: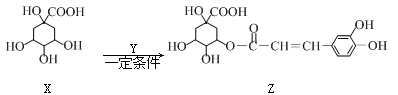
下列有关叙述中不正确的是( )
| A.Z结构中有4个手性碳原子 |
| B.Y的分子式为C9H8O4 |
| C.1 mol Z与足量NaOH溶液反应,最多消耗8 mol NaOH |
| D.Z与浓溴水既能发生取代反应又能发生加成反应 |