硫酸亚铁可与等物质的量的硫酸铵生成硫酸亚铁铵:(NH4)2SO4·FeSO4·6H2O,商品名称为莫尔盐,是一种复盐。一般亚铁盐在空气中易被氧气氧化,形成复盐后就比较稳定。与其他复盐一样,硫酸亚铁铵在水中的溶解度比组成它的每一种盐的溶解度都小,且几乎不溶于乙醇,利用这一性质可以制取硫酸亚铁铵晶体。三种盐的溶解度(单位为g/l00gH2O)见下表: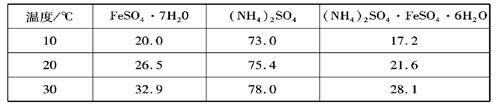
实验用品:10% Na2CO3溶液、Fe屑、3mol/LH2SO 4、( NH4)2SO4、蒸馏水、无水乙醇。
4、( NH4)2SO4、蒸馏水、无水乙醇。
实验步骤流程图: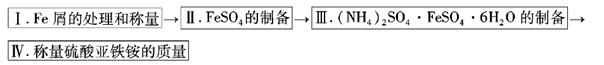
请完成以下实验记录:
(1)步骤I中处理铁屑所用试剂为________________,经处理后的干燥铁屑质量记为m1;
(2)将称量好的Fe屑放入锥形瓶中,加入适量3mol/LH2SO4溶液,放在水浴中加热至气泡量产生较少时为止(有氢气生成,用明火加热注意安全)。趁热过滤,并用少量热水洗涤锥形瓶及滤纸,将滤液和洗涤液一起转移至蒸发皿中。将滤纸上的固体常温干燥后称重,记为m2;
(3)称取一定质量的(NH4)2SO4,加入______ g(用含m1和m2的代数式表示,要求化简,下同。)水配制成室温下( 20℃)的饱和溶液,并将其加入到上面实验的蒸发皿中,缓缓加热,浓缩至表面出现结晶薄膜为止。放置冷却,得到硫酸亚铁铵的晶体,过滤后用________________洗涤晶体。
(4)称量生成的硫酸亚铁铵的质量,理论上为________________g。
24、在标准状况下,4.48L的NH3气体物质的量为mol质量为g,其中含
个氢原子, 将其溶于水配成200mL的溶液,其物质的量浓度为_mol/L。
由Na2CO3·nH2O与NaHCO3组成的混合物28.2 g,放入坩埚中充分加热至质量不变时,将残留固体用足量的盐酸溶解可产生标准状况下的气体3.36 L;若将28.2 g原混合物与盐酸反应,则放出标准状况下气体4.48 L,由此计算。
(1)残留固体质量;
(2)n值;
(3)NaHCO3质量。(写出计算求解的过程)
(12分)化学需氧量(COD)常作为衡量水体中有机物含量多少的指标。某化学课外小组的同学拟采用碱性高锰酸钾溶液测定某海水试样的COD,实验流程如下: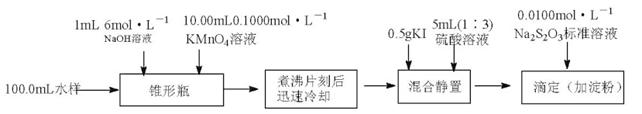
已知:①弱碱性条件下MnO4-被还原性物质还原为MnO2
②10I-+2MnO4-+16H+=5I2+2Mn2++8H2O
③2S2O32-+I2=2I-+S4O62-
(1)测定海水试样的COD,采用碱性高锰酸钾溶液而不采用酸性高锰酸钾溶液,其可能原因是。
(2)氧化后的水样煮沸后,需冷却并在暗处再加入KI和硫酸,需在暗处的原因是。用Na2S2O3,标准溶液滴定,终点时溶液颜色的变化是。
(3)滴定到终点时消耗Na2S2O3标准溶液10.00mL。根据以上实验数据计算海水试样的COD(用每升水样相当于消耗多少毫克O2表示,单位:mg•L-1)(写出计算过程)。
矿物透闪石是制作玉器的一种原料,其化学式可用CaxMgySi8O22(OH)m表示。
(1)CaxMgySi8O22(OH)m改写成氧化物的形式为,化学式中x、y、m的代数关系式为。
(2)对矿物样品粉末灼烧至恒重,则减少的质量与灼烧后固体中Si元素的质量比为(用m表示)。
(3)为确定CaxMgySi8O22(OH)m的组成,进行如下实验:
①准确称取8.10g样品粉末,加入足量稀盐酸充分溶解,过滤,将沉淀灼烧得固体4.80g。
②另准确称取16.20克样品粉末在空气中灼烧,样品减少的质量随灼烧时间的变化如图所示。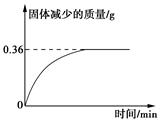
根据以上实验数据计算样品的化学式(写出计算过程)。
工业上用NH3和CO2反应合成尿素:
2NH3(g)+ CO2(g) CO(NH2)2(g)+ H2O(g) △H1 =" -536.1" kJ·mol-1
CO(NH2)2(g)+ H2O(g) △H1 =" -536.1" kJ·mol-1
(1)此反应的平衡常数表达式K=。升高温度,K值(填增大、减小或不变)。
(2)其他条件不变,下列方法能同时提高化学反应速率和尿素产率的是。
| A.通入氦气 | B.缩小体积 |
| C.加入催化剂 | D.除去体系中的水蒸气 |
(3)尿素可用于处理汽车尾气。CO(NH2)2(g)与尾气中NO反应生成CO2、N2、H2O(g)排出。又知:4NH3(g)+ 6NO(g)= 5N2(g)+ 6H2O(g) △H2 =" -1806.4" kJ·mol-1,写出CO(NH2)2(g)与NO反应的热化学方程式。
某小组模拟工业合成尿素,探究起始反应物的氨碳比[n(NH3)/n(CO2)]对尿素合成的影响。在恒温下1L容器中,将总物质的量为3mol的NH3和CO2以不同的氨碳比进行反应,实验测得平衡体系中各组分的变化如图所示。回答问题:
(4)若a、b线分别表示NH3或CO2转化率的变化,其中表示NH3转化率的是(填a或b)线。
(5)若a、b线分别表示NH3或CO2转化率的变化,c线表示平衡体系中尿素体积分数的变化,求M点对应的y值(写出计算过程,结果精确到0.1)。