阅读、分析下列两个材料:
材料一 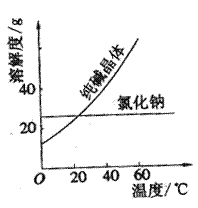
材料二
| 物质 |
熔点/℃ |
沸点/℃ |
密度/g·cm-3 |
溶解性 |
| 乙二醇 C2H6O2 |
-11.5 |
198 |
1.11 |
易溶于水和乙醇 |
| 丙三醇C3H8O3 |
17.9 |
290 |
1.26 |
能跟水、酒精以任意比互溶 |
根据上述材料及课本知识,回答下列问题(填写序号):
A.蒸馏法 B.萃取法 C.“溶解、结晶、过滤”的方法 D.分液法 E.层析
⑴将纯碱从氯化钠和纯碱的混合物中分离出来,最好应用______________,
⑵将乙二醇和丙三醇相互分离的最佳方法是______________,
⑶用CCl4提取溴水中的溴单质的最佳方法是_____________,
⑷分离汽油和水的最佳方法是_______________。
过氧化尿素是一种新型漂白、消毒剂,广泛应用于农业、医药、日用化工等领域。用低浓度的双氧水和饱和尿素溶液在一定条件下可以合成过氧化尿素。反应的方程式为:CO(NH2)2+H2O2 CO(NH2)2·H2O2。过氧化尿素的部分性质如下:
CO(NH2)2·H2O2。过氧化尿素的部分性质如下:
| 分子式 |
外观 |
热分解温度 |
熔点 |
溶解性 |
| CO(NH2)2•H2O2 |
白色晶体 |
45℃ |
75~85℃ |
易溶于水、有机溶剂 |
合成过氧化尿素的流程及反应装置图如下:

请回答下列问题:
(1)仪器X的名称是;冷凝管中冷却水从(填“a”或“b”)口进入;
(2)反应器的加热方式是。
(3)搅拌器是否可用铁质材料(填“是”或“否”),原因是;
(4)步骤①采用减压蒸发的原因是。
(5)母液可以循环使用提高原料利用率,若欲从母液中分离出H2O2和尿素, 可采用的操作是
A.盐析、过滤 B.减压蒸馏、结晶
C.分液、过滤 D.常压蒸馏、萃取
(6)准确称取0.5000g产品于250mL锥形瓶中,加适量蒸馏水溶解,再加1mL6mol·L-1H2SO4,用0.1000mol•L-1KMnO4标准溶液滴定至终点时消耗20.00mL(尿素与KMnO4溶液不反应),则产品中CO(NH2)2•H2O2的质量分数为;若滴定前滴定管尖嘴处有气泡,滴定后消失,则测得的过氧化尿素含量(填“偏高”、“偏低”或“不变”)。
实验室合成乙酸乙酯的步骤:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸汽冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品。
请回答下列问题:
(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放_______________ ,目的是__________________。
(2)反应中加入过量乙醇的目的是 ________________________ 。
(3)如果将上述实验步骤改为在蒸馏烧瓶内先加入乙醇和浓硫酸,然后通过分液漏斗边滴加醋酸,边加热蒸馏。这样操作可以提高酯的产率,其原因是
_______________________________________________________________。
(4)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作流程图。
请回答:
试剂a是________,试剂b是___________
分离方法①是 __________________
分离方法②是 __________________
分离方法③是 ___________________
某学生用0.1000mol·L-1标准NaOH溶液滴定未知浓度的盐酸,其操作可分解为以下几步:
A移取25.00mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞溶液
B用标准NaOH溶液润洗滴定管2~3次
C把盛有标准NaOH溶液的碱式滴定管固定好,挤压玻璃珠,使滴定管尖嘴充满溶液
D取标准NaOH溶液注入碱式滴定管到“0”刻度以上2~3cm
E.调节液面至“0”或“0”刻度以下,记下读数
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定到终点,并记下滴定管液面的读数
(1)下图中属于碱式滴定管的(选填:“甲”、“乙”)。
(2)正确的操作顺序是(填字母序号)。
(3)上述B步操作的目的是。
(4)判断到达滴定终点的实验现象是。
(5)上述A步操作之前,若先用待测溶液润洗锥形瓶,则对滴定结果的影响是(填“偏大”或“偏小”或“无影响”)。
(6)若平行实验三次,记录的数据如下表
| 滴定次数 |
待测溶液的体积(/mL) |
标准NaOH溶液的体积 |
|
| 滴定前读数(/mL) |
滴定后读数(/mL) |
||
| 1 |
25.00 |
1.02 |
21.03 |
| 2 |
25.00 |
2.00 |
21.99 |
| 3 |
25.00 |
0.20 |
20.20 |
试计算待测盐酸的物质的量浓度(列出计算过程)。
(1)已知草酸(H2C2O4)分解的化学方程式为:H2C2O4 CO↑+ CO2↑+ H2O,
CO↑+ CO2↑+ H2O,
下列装置中,可用作草酸分解制取气体的是(填序号)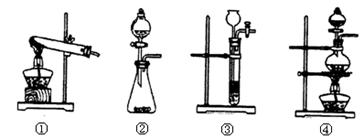
(2)某实验小组为测定铁锈样品的组成(假定铁锈中只有Fe2O3·nH2O和Fe两种成份),利用草酸分解产生的CO和铁锈反应,实验装置如下图所示。
① 为得到干燥、纯净的CO气,洗气瓶A、B中盛放的试剂分别是、。
② 在点燃C处酒精灯之前,应先持续通入一段时间的混合气体,其目的是
③ 准确称量样品的质量20.00g置于硬质玻璃管中,充分反应后冷却、称量(假设每步均完全反应),硬质玻璃管中剩余固体质量为16.64g,D中浓硫酸增重1.44g,则n=。
④、在本实验中,下列情况会使测定结果n偏大的是(填字母)
a.缺少装置A b.缺少装置B c.反应后固体是铁和少量Fe2O3·nH2O
(12分)化合物X由元素A、B组成,可用于制造高性能的现代通讯材料—光导纤维;化合物Y由不同短周期元素C、D组成,是良好的耐热、耐冲击材料。
(1)已知A的一种单质是一种重要的半导体材料,则A在元素周期表中的位置是。A可由X与焦炭在高温下反应制得,其反应的化学方程式为。
(2)X与纯碱高温熔融时能生成Z,同时还生成一种气体M;将一定量气体M通入z的水溶液中生成白色沉淀和纯碱溶液。X与纯碱高温熔融能发生反应的原因是;M与Z的水溶液能发生反应的原因是。要将纯碱高温熔化,下列坩埚中不可选用的是。
A.普通玻璃坩埚 B.石英玻璃坩埚
C.氧化铝坩埚D.铁坩埚
(3)C的单质既可与盐酸、又可与NaOH溶液反应。一定条件下,Y和水作用生成含D的化合物W,W是一种含有10个电子的碱性气体。则Y的化学式是。
(4)C的单质、石墨和二氧化钛(TiO2)按一定比例在高温下反应得到两种化合物,两种化合物均是由两种元素组成的新型陶瓷材料,则反应的化学方程式是。