(1)维生素C的结构简式为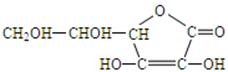
请回答:①维生素C的分子式是
②向维生素C的水溶液中滴加紫色石蕊试液,试液变红,说明维生素C的水
溶液显  性。
性。
(2)一个体重50kg的健康人,体内约含有2g铁,这2g铁在人体内不是以单质的形式存在,而是以Fe2+和Fe3+的形式存在。正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收。维生素C在这一反应中具有 性;维 生素C又称为 。
生素C又称为 。
利用从冬青中提取的有机物A合成抗结肠炎药物Y及其他化学品,合成路线如下: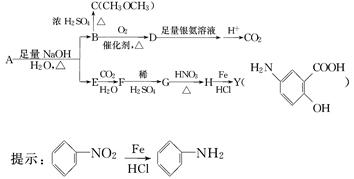
根据上述信息回答:
(1)D不与NaHCO3溶液反应,D中官能团的名称是________,B―→C的反应类型是________.
(2)写出A生成B和E的化学反应方程式____________________________________
________________________________________________________________________.
(3)A的同分异构体I和J是重要的医药中间体,在浓硫酸的作用下I和J分别生成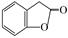 和
和 ,鉴别I和J的试剂为________.
,鉴别I和J的试剂为________.
下图是以苯酚为主要原料制取冬青油和阿司匹林的过程:
(1)写出①、②、③步反应的化学方程式(是离子反应的写离子方程式)
①________________________________________________________________________.
②________________________________________________________________________.
③________________________________________________________________________.
(2)B溶于冬青油致使产品不纯,用NaHCO3溶液即可除去,简述原因________________________________________________________________________.
(3)在(2)中不能用NaOH也不能用Na2CO3,简述原因
________________________________________________________________________.
(4)1 mol 阿司匹林最多可与________ mol 氢氧化钠发生反应.
根据下图所示的反应路线及信息填空:
(1)A的结构简式是________;名称是________
(2)①的反应类型是________;③的反应类型是________.
(3)反应④的化学方程式是______________________________________.
有以下一系列反应,最终产物为草酸. 已知B的相对分子质量比A大79,试推测用字母代表的化合物的结构简式.
已知B的相对分子质量比A大79,试推测用字母代表的化合物的结构简式.
C是____________________________;
F是____________________________.
《茉莉花》是一首脍炙人口的江苏民歌.茉莉花香气的成分有多种, 是其中的一种,它可以从茉莉花中提取,也可以用甲苯和
是其中的一种,它可以从茉莉花中提取,也可以用甲苯和
乙醇为原料进行人工合成.一种合成路线如下: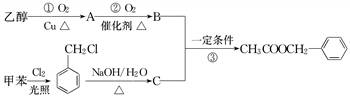
(1)写出反应①的化学方程式:__________________________________________.
(2)反应③的反应类型为______________________________________________.
(3)反应________(填序号)原子的理论利用率为100%,符合绿色化学的要求.
(4)C的结构简式为__________________________________________________,
C通常有三种不同类别的芳香族同分异构体,试写出另两种不同类别的同分异构体的结构简式(各写一种)________________________________.