(1)对反应N2O4(g) 2NO2(g) △H>0 ,在温度为T1、 T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。T1 T2(填“>”、“<”或“=”);A、C两点的速率vA vC(
2NO2(g) △H>0 ,在温度为T1、 T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。T1 T2(填“>”、“<”或“=”);A、C两点的速率vA vC( 同上)。
同上)。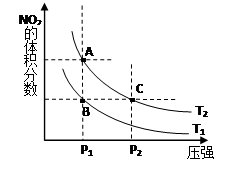
(2)在100℃时,将0.400mol的NO2气体充入2L真空定容密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间(s) |
0 |
20 |
40 |
60 |
80 |
| n(NO2)/mol |
0.40 |
n1 |
0.26 |
n3 |
n4 |
| n(N2O4)/mol |
0.00 |
0.05 |
n2 |
0.08 |
0.08 |
①在上述条件下,从反应开始直至20s时,二氧化氮的平均反应速率为 ;
②该反应的平衡常数K的值为 ;
③若在相同情况下最初向该容器充入的是N2O4,要达到上述同样的平衡状态,N2O4的起始浓度是 mol/L。
④计算③中条件下达到平衡后混合气体的平均相对分子质量为 ;(结果保留小数点后一位)
目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2+3H2  CH3OH+H2O,该反应的能量变化如图所示:
CH3OH+H2O,该反应的能量变化如图所示:
(1)甲同学认为该反应为放热反应,他的理由为: 。
(2)在体积为2 L的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2的物质的量随时间变化如下表所示。从反应开始到5min末,用CO2浓度变化表示的平均反应速率v(CO2)= ;反应达到平衡状态,此时H2的转化率为 。
| t/min |
0 |
2 |
5 |
10 |
15 |
| n(CO2)/mol |
1 |
0.75 |
0.5 |
0.25 |
0.25 |
(3)在相同温度、容积不变的条件下,能说明该反应已达平衡状态的是 (填序号)。
a.v生成(CH3OH)=v消耗(CO2)
b.CO2、H2、CH3OH、H2O的浓度均不再变化
c.n(CO2)∶n(H2)∶n(CH3OH)∶n(H2O)=1∶1∶1∶1
d.H2的消耗速率与CH3OH的消耗速率之比为3∶1
(1)已知甲烷燃料电池的总反应式为CH4+2O2+2KOH==K2CO3+3H2O,电池中有一极的电极反应为CH4+10OH--8e-=CO32-+7H2O这个电极是燃料电池的 (填“正极”或“负极”),另一个电极上的电极反应式为:
(2)已知吸热反应2HI(g) ===H2(g) + I2(g)吸收热量11kJ,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为_________kJ。
(1)为了达到下表中的实验要求,请从“供选择的化学试剂及方法”栏中,选择正确选项的字母代号填入对应的空格中。
| 序号 |
实验要求 |
答案 |
供选择的化学试剂及方法 |
| a |
检验乙酸是否具有酸性 |
A.新制的氢氧化铜悬浊液 |
|
| b |
检验植物油中是否含有碳碳双键 |
B.紫色石蕊试液 |
|
| c |
检验尿液中是否含有葡萄糖 |
C.加入饱和Na2CO3溶液,分液 |
|
| d |
除去乙酸乙酯中的少量乙酸 |
D.溴水 |
(2)A的结构简式如下:A分子中两种含氧官能团的名称是 、 。
请写出该物质与足量的金属钠发生反应的化学方程式 。
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺流程如下: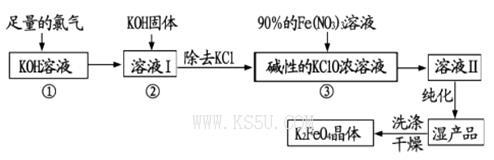
请同答下列问题:
(1)写出向KOH溶液中通入足量Cl2发生反应的离子方程式_______ 。
(2)在溶液I中加入KOH固体的目的是______(填编号)。
| A.为下一步反应提供碱性的环境 |
| B.使KClO3转化为KClO |
| C.与溶液I中过量的Cl2继续反应,生成更多的KClO |
| D.KOH固体溶解时会放出较多的热量,有利于提高反应速率 |
(3)从溶液Ⅱ中分离出K2FeO4后,还会有副产品KNO3,KCl,则反应③中发生的离子反应方程式为_______。每制得59.4克K2FeO4,理论上消耗氧化剂的物质的量为____ mol。
(4)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,配平该反应的离子方程式:___ FeO42-+___ H2O="___" Fe(OH)3(胶体)+_____O2↑+___OH-。
下列物质中(1)Na(2) Br2 (3)Na2O(4)NO2 (5)CO2 (6) SO3(7)NH3 (8)H2S(9)HCl (10)H2SO4 (11)Ba(OH)2 (12) NaCl(13)蔗糖(14)NaCl溶液。
属于电解质的是 , 属于非电解质的是 ,
能导电的是 。(用序号填写)