已知:H2(g)+O2(g)=H2O(g),反应过程中能量变化如图所示:
请回答下列问题:
(1)a、b、c分别代表的意义
a. ,
b. ,
c. ;
(2)该反应是 反应(填“放热”或“吸热”),ΔH 0(填“>”、“<”或“=”);
(3)若已知2H2 (g)+O2(g)=2H2O(g) ΔH1=-Q1kJ·mol-1;
2H2 (g)+O2(g)=2H2O(l) ΔH2=-Q2kJ·mol-1,
则ΔH1 ΔH2,Q1 Q2(填“>”“<”或“=”)。
[化学-选修化学与技术]
七水硫酸镁(MgSO4·7H2O)在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣-硼镁泥可制取七水硫酸镁。硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等)。
表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
Mg(OH)2 |
| pH值 |
5.2 |
3.2 |
9.7 |
10.4 |
11.2 |
表2 两种盐的溶解度(单位为g/100g水)
| 温度/℃ |
10 |
30 |
40 |
50 |
60 |
| CaSO4 |
0.19 |
0.21 |
0.21 |
0.20 |
0.19 |
| MgSO4·7H2O |
30.9 |
35.5 |
40.8 |
45.6 |
/ |
硼镁泥制取七水硫酸镁的工艺流程如下: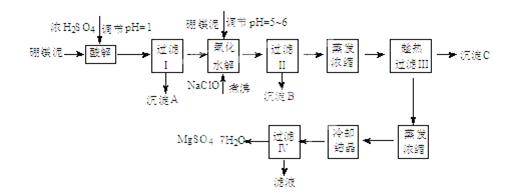
根据以上流程图并参考表格pH数据和溶解度数据,试回答下列问题:
(1)过滤I的滤液中加入硼镁泥,调节溶液的pH=5~6,再加入NaClO溶液加热煮沸,将溶液中的 Mn2+氧化成MnO2,反应的离子反应方程式为。加热煮沸的主要目的是。
(2)沉淀B中除MnO2、SiO2外还含有(填化学式)等物质。
(3)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是;
(4)沉淀C的化学式是。过滤III需趁热过滤的理由是
甲醇是重要的化学工业基础原料和清洁液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
| 化学反应 |
平衡常数 |
温度℃ |
|
| 500 |
800 |
||
①2H2(g)+CO(g) CH3OH(g) CH3OH(g) |
K1 |
2.5 |
0.15 |
②H2(g)+CO2(g) H2O (g)+CO(g) H2O (g)+CO(g) |
K2 |
1.0 |
2.50 |
③3H2(g)+CO2(g) CH3OH(g)+H2O (g) CH3OH(g)+H2O (g) |
K3 |
(1)反应②是(填“吸热”或“放热”)反应。
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系,如图所示。则平衡状态由A变到B时,平衡常数K(A)K(B)(填“>”、“<”或“=”)。据反应①与②可推导出K1、K2与K3之间的关系,则K3=(用K1、K2表示)。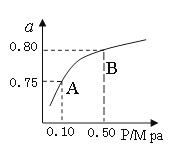
(3)在3 L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。
当曲线Ⅰ变为曲线Ⅱ时,改变的条件是。
当曲线Ⅰ变为曲线Ⅲ时,改变的条件是。
(4)甲醇燃料电池有着广泛的用途,同时Al-AgO电池是应用广泛的鱼雷电池,其原理如图所示。该电池的负极反应式是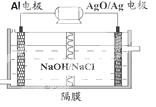
(5)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,将a mol/L的醋酸与b mol/LBa(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)= c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为。
二氧化钛广泛应用于各类结构表面涂料、纸张涂层等,二氧化钛还可作为制备钛单质的原料。
Ⅰ.二氧化钛可由以下两种方法制备:
方法1:TiCl4水解生成TiO2·xH2O,过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2,此方法制备得到的是纳米二氧化钛。
(1)① TiCl4水解生成TiO2·x H2O的化学方程式为_______________________________;
② 检验TiO2·x H2O中Cl-是否被除净的方法是______________________________。
方法2:可用含有Fe2O3的钛铁矿(主要成分为FeTiO3,其中Ti元素化合价为+4价)制取,其主要流程如下: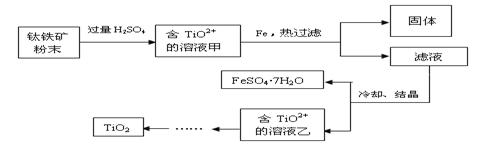
(2)Fe2O3与H2SO4反应的离子方程式是。
(3)甲溶液中除含TiO2+之外还含有的金属阳离子有。
(4)加Fe的作用是。
Ⅱ.二氧化钛可用于制取钛单质
(5)TiO2制取单质Ti,涉及到的步骤如下: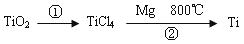
反应②的方程式是,该反应需要在Ar气氛中进行,请解释原因:_____________。
一定温度下,将3molA气体和1molB气体通过一密闭容器中,发生如下反应: 3A(g)+B (g) xC(g)。若容器体积固定为2L,反应1min时测得剩余1.8molA,C的浓度为0.4mol/L。请填写下列空白:
xC(g)。若容器体积固定为2L,反应1min时测得剩余1.8molA,C的浓度为0.4mol/L。请填写下列空白:
(1) x=;1min内,B的平均反应速率为_________;
(2)若反应经2min达到平衡,平衡时C的浓度_________0.8mol/L(填“大于”、“等于”或“小于”);
(3)平衡混合物中,C的体积分数为22%,若维持容器压强不变,达到平衡时C的体积分数_________22%,(填“大于”、“等于”或“小于”);
(4)若改变起始物质加入的量,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(A)、n (B)、n(C)之间应满足的关系式__________________ 。
金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下,在密闭容器中用H2还原WO3可得到金属钨,其总反应为:
WO3 (s) + 3H2 (g) W (s) + 3H2O (g)
W (s) + 3H2O (g)
请回答下列问题:
⑴上述反应的化学平衡常数表达式为___________________________。
⑵某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为_____________________;随温度的升高,H2与水蒸气的体积比减小,则该反应为反应_____________________(填“吸热”或“放热”)。
⑶上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
| 温度 |
25℃ ~ 550℃ ~ 600℃ ~ 700℃ |
| 主要成份 |
WO3 W2O5 WO2 W |
第一阶段反应的化学方程式为___________________________;580℃时,固体物质的主要成分为________;假设WO3完全转化为W,则三个阶段消耗H2物质的量之比为____________________________________。
⑷ 已知:温度过高时,WO2 (s)转变为WO2 (g);
WO2 (s) + 2H2 (g)  W (s) + 2H2O (g);ΔH = +66.0 kJ·mol-1
W (s) + 2H2O (g);ΔH = +66.0 kJ·mol-1
WO2 (g) + 2H2(g)  W (s) + 2H2O (g);ΔH = -137.9 kJ·mol-1
W (s) + 2H2O (g);ΔH = -137.9 kJ·mol-1
则WO2 (s)  WO2 (g) 的ΔH = ______________________。
WO2 (g) 的ΔH = ______________________。
⑸钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W (s) +2I2 (g)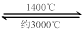 WI4 (g)。下列说法正确的有____________。
WI4 (g)。下列说法正确的有____________。
a.灯管内的I2可循环使用
b.WI4在灯丝上分解,产生的W又沉积在灯丝上
c.WI4在灯管壁上分解,使灯管的寿命延长
d.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢