MnO2是一种重要的功能无机材料,粗MnO2的提纯是工业生产的重要环节。某研究性学习小组设计了将粗MnO2(只含有较多的MnO和MnCO3)样品转化为纯MnO2的实验,其流程如下:

(1)第①步加稀H2SO4时,将粗MnO2样品中▲ ,▲ (写化学式)转化为可溶性物质。
(2)第②步反应的离子方程式是(补充完整并配平): Mn2++ ClO3—+ = MnO2↓+ Cl2↑+ ;
(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、 ▲  、 ▲ 、玻璃棒。
、 ▲ 、玻璃棒。
(4)若粗MnO2样品的质量为12.69g,第①步反应后,经过滤得到8.7g MnO2,并收集到0.224LCO2(标准状况下),则在第①步反应中至少需要▲ mol H2SO4。写出计算过程 (已知摩尔质量:MnO2 -87g/mol; MnO-71g/mol; MnCO3-115 g/mol)
(5)已知2H2O2(l)=2H2O(l)+O2(g)△H=a kJ·mol-1反应过程的能量变化如图所示。则
①该反应为 ▲ 反应(填“吸热”或“放热”)。
②请用虚线在右图中画出使用MnO2作催化剂的情况下反应过程中体系能量变化示意图。

|
在T℃条件下,向1L固定体积的密闭容器M中加入2 mol X和1 mol Y,发生如下反应: 2X(g) + Y(g)  a Z(g) + W(g) △H = -Q kJ·mol-1 (Q>0)当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小,则:
a Z(g) + W(g) △H = -Q kJ·mol-1 (Q>0)当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小,则:
(1)化学计量数a的值为。
(2)下列说法中能说明该反应达到了化学平衡状态的是。
A.容器内压强一定 B.容器内气体的密度一定
C.容器内Z分子数一定 D.容器内气体的质量一定
(3)X的转化率α= (用含Q、Q1的代数式表示)。
(4)维持温度不变,若起始时向容器中加入的物质的量如下列各项,则反应达到平衡后放出的热量仍为Q1kJ的是(稀有气体不参与反应)。
A.2 molX、1mol Y、1molAr
B.a molZ、1mol W
C.1 molX、0.5mol Y、0.5a molZ、0.5 mol W
D.2 molX、1mol Y、1molZ
(5)维持温度不变,若起始时向容器中加入4mol X和6 mol Y,若达平衡时容器内的压强减小了10%,则反应中放出的热量为kJ。
已知:该反应的平衡常数随温度的变化如下表:
| 温度/℃ |
200 |
250 |
300 |
350 |
| 平衡常数K |
9.94 |
5.2 |
1 |
0.5 |
试回答下列问题
(6)在300℃发生上述反应,以表中的物质的量投入到相同的恒容反应器中,其中向正反应方向转化的有(选填A.B.C.D.E)。
| n(X) |
n(Y) |
n(Z) |
n(W) |
|
| A |
1 |
5 |
2 |
3 |
| B |
2 |
2 |
1 |
1 |
| C |
3 |
3 |
0 |
6 |
| D |
0.5 |
2 |
1 |
1 |
| E |
1 |
0.3 |
2 |
2 |
(7)若在某温度下,2 mol X和1 mol Y在该容器中反应达平衡, X的平衡转化率为50%,则该温度为℃。
(8)维持T℃条件不变,若在一个和原容器体积相等的恒压容器N 中,加入2 mol X和1 mol Y发生如上反应并达平衡,则(选填M或N)容器中的反应先达到平衡状态。
某研究性学习小组在网上收集到如下信息:钾、钙、钠、镁等活泼金属都能在CO2气体中燃烧。他们对钠在CO2气体中燃烧后的产物中的白色物质进行了如下探究:
[实验]将燃烧的钠迅速伸入到盛有装满CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上粘附着白色物质。
[提出假设]
假设1:白色物质是Na2O。
假设2:白色物质是Na2CO3。
假设3:白 色物质是Na2O和Na2CO3的混合物。
色物质是Na2O和Na2CO3的混合物。
[设计实验方案.验证假设]:该小组对燃烧后的白色产物进行如下探究:
| 实验 方案 |
实验操作 |
实验现象 |
结论 |
| 方案1 |
取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 |
溶液变成红色 |
白色物质为Na2O |
| 方案2 |
①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液 |
出现白色沉淀 |
|
| ③静置片刻,取上层清液于试管中,滴加无色酚酞试液 |
无明显 现象 |
[思考与交流]
(1)甲同学认为方案1得到的结论不正确,其理由是。
(2)乙同学认为方案2得到的结论正确,白色物质为。
(3)通过方案1和方案2的实验,你认为上述三个假设中,成立。你的理由是。由此得出钠在二氧化碳中燃烧的化学方程式为。
(4)丙同学认为白色物质有可能是氢氧化钠。你______(是.否)同意丙同学的观点,并简述理由:。
氮及其化合物与人们的生活息息相关。
(1)氮元素在周期表中的位置是。
(2)实验室可用铜与稀硝酸反应制取NO ,其离子方程式是。为防止环境污染,可用碱液吸收氮的氧化物。NO与NO2按物质的量之比1:1被NaOH溶液完全吸收后得到一种钠盐,该化学方程式是。
,其离子方程式是。为防止环境污染,可用碱液吸收氮的氧化物。NO与NO2按物质的量之比1:1被NaOH溶液完全吸收后得到一种钠盐,该化学方程式是。
(3)已知:① CH4(g) + 4 NO2(g) =" 4" NO(g) + CO2(g) +2 H2O(g) △H=-574 kJ·mol-1
② CH4(g) + 4 NO(g) =" 2" N2(g) + CO2(g) + 2 H2O(g) △H= -1160 kJ·mol-1
根据①和②,标准状况下,4.48 L CH4恰好将NO2转化为N2时,△H=。
(4)同温同压下,3.5 L NH3恰好将3.0 L NO和NO2的 混合气完全转化为N2,则原混合气中 NO和NO2的体积比是 。
(5)含有1mol HNO3的稀硝酸分别与不同质量的铁粉充分反应,所得氧化产物a、b与铁粉物质的量关系如图所示。则b是
(填化学式),n3 =mol。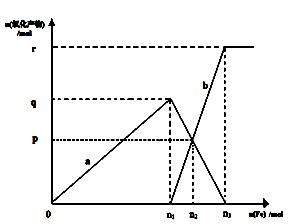
用标签如图的浓硫酸配得200 mL某浓度的稀硫酸,现将27.2 g铁粉和氧化铁的混合物加入其中,恰好完全反应,放出氢气2.24 L(标准状况)。反应后的溶液中滴加KSCN不显红色,且无固体剩余物,求:(计算结果保留小数点后1位)
①配制200 mL该稀硫酸,需要浓硫酸 ▲mL;
②混合物中氧化铁的质量为 ▲g;
③稀硫酸的物质的量浓度为 ▲mol·L-1。
有一包白色固体物质,可能含有CuSO4、Na2SO4、KCl、Na2CO3、MgCl2中的一种或几种,现进行如下实验:
(1)将白色固体溶于水中,得到无色透明溶液。
(2)取少量上述溶液两份,其中一份滴加BaCl2溶液,立即产生白色沉淀,再加入稀
硝酸,沉淀没有溶解。另一份溶液中滴加NaOH溶液,有白色沉淀生成。
根据以上实验现象可知,该白色固体中一定含有 ▲,一定没有 ▲,可能有 ▲。