二氧化氯(ClO2)是目前国际上公认的第四代高效、无毒的消毒剂,是一种黄绿色的气体,易溶于水。
Ⅰ.(1)ClO2可由KClO3在H2SO4存在的条件下与Na2SO3反应制得。则该反应的氧化产物与还原产物的物质的量之比是________。
Ⅱ.实验室也可用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2,其流程如下:
(2)写出电解时发生反应的化学方程式:________________________________。
(3)除去ClO2中的NH3可选用的试剂是________。(填序号)
| A.饱和食盐水 | B.碱石灰 |
| C.浓硫酸 | D.水 |
(4)测定ClO2(如图)的过程如下:在锥形瓶中加入足量的碘化钾,用100 mL水溶解后,再加3 mL硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收;将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用c mol·L-1硫代硫酸钠标准溶液滴定(I2+2S2O32-=2I-+S4O62-),共用去V mL硫代硫酸钠溶液。
①装置中玻璃液封管的作用是______________________________________。
②请写出上述二氧化氯气体与碘化钾溶液反应的离子方程式__________________________。
③滴定终点的现象是_______________________________________________。
④测得通入ClO2的质量m(ClO2)=________。(用含c、V的代数式表示)
(5)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子ClO2-。2001年我国卫生部规定,饮用水的ClO2-含量应不超过0.2 mg·L-1。若饮用水中ClO2-的含量超标,可向其中加入适量的某还原剂,该反应的氧化产物是________(填化学式),其发生反应的离子方程式为_________________________________________________________________。
下图所涉及的物质均为中学化学中的常见物质,其中C为无色气体单质,D为有色气体单质,E为金属单质,其余为化合物。它们存在如下转化关系(反应中生成的水及次要产物均已略去)。
(1)写出有关物质的化学式:F________,H________。
(2)若反应①是在加热条件下进行,则A是________;若反应①是在常温条件下进行,则A是________。
(3)写出B与MnO2共热获得D的化学方程式______________________________。
(4)B的稀溶液与AgNO3溶液混合可形成沉淀AgX,已知Ksp(AgX)=1.8×10-10。将B的稀溶液与AgNO3溶液等体积混合,若B的浓度为2×10-4 mol·L-1,则生成沉淀所需AgNO3溶液的最小浓度为________mol·L-1。若向AgX悬浊液中滴加KI溶液,观察到的现象是______________________________,沉淀能够发生转化的原因是_________________________________________。
已知化合物A、B、M、N含有同一种元素,且A与B,M与N的元素组成相同,A与B在常温下均呈液态。D为固体单质,与X的浓溶液在常温下作用无明显现象,加热时有大量气体产生。(相关转化中所有反应物与生成物均已标出)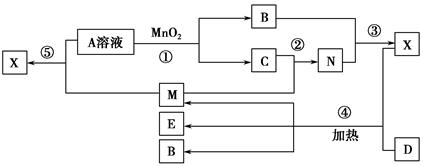
(1)若D与E溶液能够发生化合反应。且溶液在反应前后颜色有变化。
①A的电子式为________。D的化学式为________。
②M与E溶液可发生反应生成X,其离子方程式为________________________
_________________________________________________________________。
(2)若D为常见的红色金属单质。用情性电极电解100 mL 0.05 moL·L-1E溶液,导线中通过0.08 mol电子,阳极析出的气体体积为________mL(标准状况),假设溶液体积不变,则所得溶液pH=________。
(3)若D为短周期元素形成的黑色固体单质。反应④的化学方程式为_________________________________________________________________。
(4)已知下列几种试剂:
a.无水CuSO4
b.品红溶液
c.酸性KMnO4溶液
d.澄清石灰水
e.饱和NaOH溶液
为了检验(3)中D与X生成的混合气体的成分,某学生用上述试剂(或部分试剂)设计了几种实验方案,下列试剂使用顺序最合理的是________(填序号)。
A.abebdB.adeb C.abcbd D.abd
氨气是一种重要的工业产品,也是一种重要的化工原料。为研究氨气的制备及性质,某学习小组进行了下面的探究活动:
(1)实验室中往往采用熟石灰与氯化铵制备氨气,写出该反应的化学方程式(注明反应条件)__________________________________________________。
(2)实验室中还可以采用如图装置(略去了夹持装置)和药品快速制备氨气:
①甲同学不明白该方法中制备氨气的原理,于是学习小组内成员展开了讨论,得出了下面的结论,其中不正确的是________(填字母序号)。
a.氨水中的NH3·H2O分解
b.氨水中存在可逆反应:NH3·H2O  NH4++OH-,NaOH晶体使该可逆反应的平衡向左移动
NH4++OH-,NaOH晶体使该可逆反应的平衡向左移动
c.反应原理与铵盐、熟石灰制备氨气的反应原理相同
d.NaOH溶于水放出热量,使NH3·H2O分解
②乙同学取质量分数为34%的0.89 g·mL-1的浓氨水10 mL,用过量的NaOH与之混合,然后用500 mL的烧瓶收集氨气。请你计算最多可收集满标准状况下的氨气________个烧瓶。
(3)丙同学进行氨气的喷泉实验探究。
①收集氨气时需要用干燥剂干燥,如图,装置B中盛装的干燥剂是________。
②该同学利用图装置,成功地完成了喷泉实验。请你简要地写出该同学操作的正确方法:____________________________________________________。
明矾石的主要成分为K2SO4·Al2(SO4)3·2Al2O3·6H2O,此外还含有少量Fe2O3杂质。某校研究小组利用明矾石制备氢氧化铝的流程如下:
(1)“焙烧”过程中反应的化学方程式为 Al2(SO4)3+
Al2(SO4)3+ S
S
 Al2O3+
Al2O3+ ______↑。
______↑。
(2)分离溶液和废渣的操作是________,“溶解”时反应的离子方程式为_________________________________________________________________。
(3)“调节pH”后过滤、洗涤Al(OH)3沉淀,证明沉淀已洗涤干净的实验操作和现象是________。
(4)“母液”中可回收的物质是________。
(5)若“焙烧”过程中恰好消耗48 g硫黄,则理论上最终可得到________ g氢氧化铝。