在一定温度下将1mol CO和3mol水蒸气放在密闭的容器中发生下列反应:CO( g)+H2O(g)
g)+H2O(g) CO2(g)+H2(g)达到平衡
CO2(g)+H2(g)达到平衡 后,测得CO2为0.75mol,再通入6mol水蒸气,达到新的平衡后,CO2和H2的
后,测得CO2为0.75mol,再通入6mol水蒸气,达到新的平衡后,CO2和H2的 物质的量之和为( )
物质的量之和为( )
| A.1.2mol | B.1.5mol | C.1.8mol | D.2.5mol |
若a、b、c、d均大于零,下列能正确表示燃烧热的热化学方程式为
| A.CH3CH2OH(l) + 3O2 (g) = 2CO2 (g) + 3H2O(l)ΔH =-a kJ/mol |
| B.CH4 (g) + 2O2 (g) = 2H2O(g) + CO2 (g)ΔH =-b kJ/mol |
C.H2 (g) +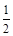 O2 (g) = H2O(l)ΔH = c kJ/mol O2 (g) = H2O(l)ΔH = c kJ/mol |
| D.2CH≡CH(g) + 5O2(g) =4CO2 (g) + 2H2O(l)ΔH =-d kJ/mol |
下列化学式只表示一种分子的是
| A.C2H6O | B.(C6H10O5)n | C.—CH2CH3 | D.C2H4 |
2.某化学反应其ΔH =-125 kJ/mol,∆S =" 81" J/(mol·K),则此反应在下列哪种情况下可自发进行
| A.在任何温度下都能自发进行 | B.在任何温度下都不能自发进行 |
| C.仅在高温下自发进行 | D.仅在低温下自发进行 |
下列有关煤的说法中不正确的是
| A.煤是工业上获得芳香烃的重要来源 |
| B.开发新能源,减少燃煤,是控制酸雨,保护环境的有效途径之一 |
| C.煤、石油、水煤气均是可再生能源 |
| D.煤的干馏和石油的裂解过程均属于化学变化过程 |
常温下,用0.1000 mol/L HCl溶液滴定20.00 mL 0.1000 mol/L NH3•H2O溶液,滴定曲线如下图。下列说法正确的是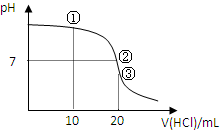
| A.①溶液:c(C1—)>c(NH4+)>c(OH—)>c(H+) |
| B.②溶液:c(NH4+)=c(C1—)>c(OH—)=c(H+) |
| C.③溶液:c(H+)>c(NH3·H2O) + c(OH—) |
| D.滴定过程中可能出现:c(NH3•H2O)>c(NH4+)>c(OH—)>c(Cl—)>c(H+) |