雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1) As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。写出此反应的化学方程式 。
(2)上述反应中的氧化剂是 ,氧化产物是  。
。
(3) As2S3和HNO3有如下反应:As2S3+ 10HNO3=2H3AsO4+ 3S+10NO2↑+ 2H2O
若生成1mol H3AsO4,则反应中转移电子的物质的量为 。
(4)在3Cu + 8HNO3= 3Cu(NO3)2 + 2NO↑+4H2O的反应中,有6.4g铜被氧化,参加反应的HNO3的质量是____________g,被还原的HNO3的质量是__________g。
(5)在一定条件下,P bO2与Cr3+反应,产物是Cr2O72-和Pb2+,则生成1mol C
bO2与Cr3+反应,产物是Cr2O72-和Pb2+,则生成1mol C r2O72-
r2O72-
反应所需PbO2的物质的量为__________ ____。
____。
2SO2(g)+O2(g)  2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH= -99kJ·mol—1.请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH= -99kJ·mol—1.请回答下列问题:
(1)图中A、C分别表示______________________、__________________________ ,E的大小对该反应的反应热有无影响?________________。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?___________理由是_____________________________.
(2)图中△H= _______________ KJ·mol—1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式_________________________________________
(4)如果反应速率υ(SO2)为0.05 mol·L—1·min—1,则υ(O2)= ______________mol·L—1·min—1、υ(SO3)="____________" mol·L—1·min—1;
(5)已知单质硫的燃烧热为296 KJ·mol—1,计算由S(s)生成3 molSO3(g)的△H______________(要求计算过程)。
(10分)某温度下,在一密闭容器中充入一定量CO2,并加入足量铁粉,发生反应:Fe(s)+CO2(g) FeO(s)+CO(g),测得CO2和CO浓度随时间的变化如图所示:
FeO(s)+CO(g),测得CO2和CO浓度随时间的变化如图所示: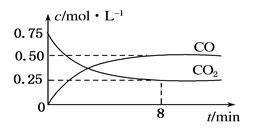
(1)0~8 min,v(CO)=______________________mol·L-1·min-1。
(2)下列措施中,能够改变平衡时c(CO)/c(CO2)的比值的是________(填选项字母)。
| A.温度 | B.铁粉的量(足量) | C.压强 | D.CO的量 |
(3)已知:反应Fe(s)+CO2(g) FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g) FeO(s)+H2(g)的平衡常数为K2。不同温度时K1、K2的值如下表:
FeO(s)+H2(g)的平衡常数为K2。不同温度时K1、K2的值如下表:
| 温度/K |
K1 |
K2 |
| 973 |
1.47 |
2.38 |
| 1 173 |
2.15 |
1.67 |
根据表中数据,计算反应CO2(g)+H2(g)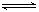 CO(g)+H2O(g)的K3
CO(g)+H2O(g)的K3
①温度为973 K时:K=_______________;
②温度为1 173 K时:K=________________;
③反应CO2(g)+H2(g)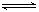 CO(g)+H2O(g)是________反应(填“吸热”或“放热”)。
CO(g)+H2O(g)是________反应(填“吸热”或“放热”)。
(10分)在密闭容器中,使2 mol N2和6 mol H2混合发生下列反应:
N2(g)+3H2(g)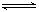 2NH3(g)(正反应为放热反应)
2NH3(g)(正反应为放热反应)
(1)当反应达到平衡时,N2和H2的浓度比是________;
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量________,密度________。(填“变大”“变小”或“不变”)
(3)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将________(填“向左移动”“向右移动”或“不移动”)。达到新平衡后,容器内温度________(填“大于”“小于”或“等于”)原来的2倍。
(8分)为了研究化学反应A+B===C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升。试回答下列问题: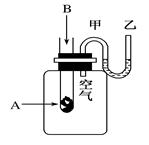
(1)该反应为________反应(填“放热”或“吸热”)。
(2)A和B的总能量比C和D的总能量________(填“高”或“低”)。
(3)物质中的化学能通过________转化成________释放出来。
(4)反应物化学键断裂吸收的能量________(填“高”或“低”)于生成物化学键形成放出的能量。
(5)写出一个符合题中条件的化学方程式:_____________________________________。
2SO2(g)+O2(g)  2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH= -99kJ·mol—1.请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH= -99kJ·mol—1.请回答下列问题:
(1)图中A、C分别表示______________________、__________________________ ,E的大小对该反应的反应热有无影响?________________。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?___________理由是_____________________________.
(2)图中△H= _______________ KJ·mol—1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式_________________________________________
(4)如果反应速率υ(SO2)为0.05 mol·L—1·min—1,则υ(O2)= ______________mol·L—1·min—1、υ(SO3)="____________" mol·L—1·min—1;
(5)已知单质硫的燃烧热为296 KJ·mol—1,计算由S(s)生成3 molSO3(g)的△H______________(要求计算过程)。