合成氨是重要的化学工业,为了研究合成氨的反应原理,在一密闭容器内充入1 mol N2和2 mol H2,在一定条件下,使之发生如下反应:N2+3H2  2NH3。
2NH3。
Ⅰ:若维持温度不变,且密闭容器的容积固定为1 L。
L。
(1) 当此反应经过2 min达到平衡状态时,测得反应混合物中NH3的物质的量为0.2 moL,则H2在2 min内的平均反应速率为__________________。
(2)如果开始时,向该容器内加入0.5 moL N2,要使反应混合物中三种气体的物质的量分数仍与上述平衡时的完全相同,则还必须加入H2 _______mo l和NH3 _______mol。
l和NH3 _______mol。
(3)如果开始时加入N2、H2、NH3的物质的量分别为a mol 、b mol 、c mol ,要使反应达到平衡状态时,反应混合物中三种气体的物质的量分数仍与(1)平衡时完全相同,则a、b、c应满足的一般条件是(a、b分别用含c的方程式表示) 。
Ⅱ:若温度维持不变,体系压强维持与Ⅰ相同,密闭容器的容积由1 L随反应进行而改变。
(4)开始时加入1 mol N2和2 mol H2,经过一段时间,容器中三种气体的物质的量分数不再发生变化时,则NH3的物质的量为__________(选填一个编号)
(甲)大于0.2 mol (乙)等于0.2 mol
(丙)小于0.2 mol (丁)可能大于、等于或小于0.2mol
作出此判断的理由是__________________________________________。
元素周期表是学习物质结构与性质的重要工具。下表是元素周期表的一部分,表中所列字母A、B、D、E、G、H、Q、M、R分别代表某一化学元素。请用所给元素回答下列问题。
| A |
|||||||||||||||||
| M |
B |
D |
|||||||||||||||
| G |
H |
Q |
R |
||||||||||||||
| E |
|||||||||||||||||
(1)Q元素在元素周期表中的位置,E元素原子结构示意图为
(2)E、Q、R三种元素的原子可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是(填离子符号)_________________________________。
(3)M、D两元素形成的化合物中含有的化学键类型是,其MD2分子的结构式:
(4)用电子式表示物质GDA_________________; 用电子式表示G与Q形成化合物的过程;
(5)用表中所给元素组成反应物,请各用一个化学方程式说明元素Q和R非金属性的强弱:;元素G、H的金属性强弱:
Ⅰ、一定温度下,在容积为V L的密闭容器中进行反应:aN(g) bM(g),M、N的物质的量随时间的变化曲线如图所示:
bM(g),M、N的物质的量随时间的变化曲线如图所示: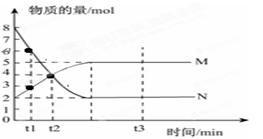
(1)此反应的化学方程式中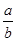 =__________
=__________
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为:
(3)平衡时,N的转化率为。
(4)下列叙述中能说明上述反应达到平衡状态的是
| A.反应中M与N的物质的量之比为1︰1 |
| B.混合气体的总质量不随时间的变化而变化 |
| C.混合气体的总物质的量不随时间的变化而变化 |
| D.单位时间内每消耗a mol N,同时生成b mol M |
E.混合气体的压强不随时间的变化而变化F.N的质量分数在混合气体中保持不变
II、某研究性学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:
实验①:把纯锌片投入到盛有稀盐酸的试管中,发现氢气发生的速率变化如图所示:
实验②:把纯锌片投入到含FeCl3的同浓度工业稀盐酸中,发现放出氢气的量减少。
实验③:在盐酸中滴入几滴CuCl2溶液,生成氢气速率加快。
试回答下列问题:
(1)试分析实验①中t1~t2速率变化的主要原因是,t2~t3速率变化的主要原因是。
(2)实验②放出氢气的量减少的原因是。
(3)某同学认为实验③反应速率加快的主要原因是因为形成了原电池,你认为是否正确?
(填“正确”或“不正确”)。请选择下列相应的a或b作答。
a、若不正确,请说明原因:
b、若正确则写出实验③中原电池的正极电极反应式。
在一容积为2L的密闭容器中加入2molA和6molB,保持温度为20℃,在催化剂存在的条件下进行下列反应:A(g)+2B(g)  2C(g),达平衡后生成1.2mol C,平衡混合气体中C的体积分数为ω。
2C(g),达平衡后生成1.2mol C,平衡混合气体中C的体积分数为ω。
(1)求20℃时,该反应的平衡常数K(保留三位有效数字)
(2)20℃时,若在同一容器中加入1molA、mol B和mol C,则平衡混合气中C的体积分数仍为ω。
在一容积为2 L的密闭容器内加入0.2 molA和0.6 molB,在一定条件下发生反应:A(s)+3B(g) 2C(s)+3D(g) 已知该反应在不同温度下的平衡常数如下表:
2C(s)+3D(g) 已知该反应在不同温度下的平衡常数如下表:
| 温度/℃ |
1000 |
1150 |
1300 |
| 平衡常数 |
64.0 |
50.7 |
42.9 |
请回答下列问题:
(1)该反应的平衡常数表达式K=,ΔH0(填“>”或“<”)。
(2)1000 ℃时,4 min后达到平衡.求4 min内D的平均反应速率v(D)=,B的平衡转化率为,平衡时B的体积分数。
(3)欲提高⑵中B的平衡转化率,可采取的措施是
A.减少C的量B.增加A的量 C.移出部分D
D.降低反应温度 E.减小容器的容积 F.加入合适的催化剂
(4)1000 ℃时, 在一容积为2 L的密闭容器内加入XmolC和0.6 molD,5 min后达到平衡,B的浓度与⑵中B的浓度相同,求X的范围
(5)下列说法中能说明反应已达到平衡状态的是
A.容器内混合气体的压强不随时间变化而变 B.B的速率不随时间的变化而变化
C.c(B)︰c(D)=1︰1 D.混合气体的密度保持不变(M(B)≠M(D))
常温下,某水溶液中存在的离子有:Na+、B2-、HB-、H+、OH-,存在的分子有H2O、H2B。根据题意回答下列问题:
(1)写出酸H2B的电离方程式﹑。
(2)常温下,已知0.1 mol·L-1二元酸H2B溶液中c(OH-) / c(H+)=1×10-6。
①常温下,0.1 mol·L-1H2B溶液的pH=;
②写出该酸(H2B)与少量NaOH溶液反应的离子方程式:;
(3)常温下,将100 mL 0.1 mol·L-1的稀H2SO4溶液与100 mL 0.4 mol·L-1的NaOH溶液充分混合(溶液体积变化忽略不计),所得溶液的pH=。
(4)t℃时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数Kw=。该温度下(t℃),0.1 mol·L-1HCl溶液的pH=;