下图表示在没有通风橱的条件下制备氯气时的装置,图中a、b是可控制的弹簧铁夹。(已知:氯气在饱和氯化钠溶液中的溶解度较小。)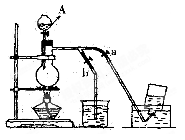
(1)仪器A的名称是 ;
烧杯中盛放的是 ;
烧瓶中发生的反应化学方程式为 ;
(2)在收集氯气时,应  。(填:如何操作a、b止水夹,下同),
。(填:如何操作a、b止水夹,下同),
当氯气收集完毕时应 。
(3)若制得标准状况下的Cl2为0.672L,则被氧化的HCl的物质的量是
实验室用乙酸和正丁醇制备乙酸正丁酯。有关物质的相关数据如下表。
| 化合物 |
相对分子质量 |
密度/g·cm-3 |
沸点/℃ |
溶解度/100g水 |
| 正丁醇 |
74 |
0.80 |
118.0 |
9 |
| 冰醋酸 |
60 |
1.045 |
118.1 |
互溶 |
| 乙酸正丁酯 |
116 |
0.882 |
126.1 |
0.7 |
请回答有关问题。
Ⅰ.乙酸正丁酯粗产品的制备
在A中加入11.5mL正丁醇和7.2mL冰醋酸,再加3~4滴浓硫酸,混合均匀,投入沸石。如图所示安装分水器、温度计及回流冷凝管,并在分水器中预先加水至略低于支管口,加热回流,反应一段时间将水逐渐分去,至反应完毕。
(1)仪器A中发生反应的化学方程式为____________________________。有同学拟通过某种方法鉴定所得产物中是否含有杂质,可采用确定。
a.红外光谱法 b.1H核磁共振谱法 c.质谱法
(2)“反应中利用分水器将水分去”该操作的目的是:。
(3)反应时加热有利于提高酯的产率,但温度过高酯的产率反而降低,其可能的原因是。
(4)可根据现象来判断反应完毕。
Ⅱ.乙酸正丁酯粗产品的精制
(5)将仪器A中的液体转入分液漏斗中,用分液法可分离上述有机层和水层,分液完成后,取出有机层的操作是。
(6)再用10ml 10%Na2CO3溶液洗涤有机层,该步操作的目的是。
(7)将干燥后的产品蒸馏收集乙酸正丁酯产品时,应将温度控制在左右。
(本题共12分)
下图是模拟工业制硝酸原理的实验装置。先用酒精灯对硬质玻璃管里的三氧化二铬加热,然后把空气鼓入盛有浓氨水的锥形瓶,当三氧化二铬保持红热状态时,移去酒精灯。根据题意回答:
1.硬质玻璃管里发生反应的化学方程式为。
当三氧化二铬红热时,要移去酒精灯,原因是:。
2.圆底烧瓶里的实验现象是,鼓入空气的作用是。
3.实验过程中,如果慢慢地鼓入空气,石蕊溶液的颜色。
4.实验结束后,在圆底烧瓶内壁上有时会看到少量无色晶体,写出生成该晶体的化学方程式:。
5.新制的三氧化二铬催化效果较好。实验室一般用加热分解(NH4)2Cr2O7的方法制三氧化二铬,反应的化学方程式为。
6.工业上要获得浓度较大的硝酸,往往在稀硝酸中加入吸水剂硝酸镁或浓硫酸,然后(填一种操作名称)。实验室里保存浓硝酸的方法是。
实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验。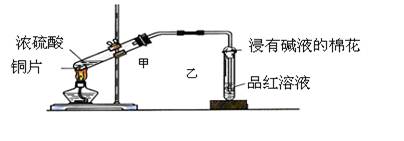
(1)根据什么现象可判断铜跟浓硫酸反应有SO2生成_____________________;
根据什么现象可判断铜跟浓硫酸反应有硫酸铜生成______________________;写出甲装置中发生的主要反应的化学方程式。
(2)装置乙的试管口部放有一团浸有碱液的棉花,棉花中通常是浸有饱和碳酸钠溶液,其作用是_________。
(3)实验完毕后,取少量乙试管中溶液于试管中加热,现象是;原因是。
某研究性学习小组的课题为“Mg—Cu硫酸原电池电解CuCl2溶液的研究”,他们的研究装置如下图所示(C1、C2均为碳棒),按要求填写下列空格。
(1)铜片上的现象是,该极的电极反应式为。
(2)C1极的名称为,C2极的电极反应式为。
(3)下列关于该装置中电子流向的叙述中正确的是。
| A.从镁电极经导线流向C1极 | B.从C1极经导线流向镁电极 |
| C.从铜电极经导线流向C2极 | D.从C2极经导线流向铜电极 |
(4)原电池中稀硫酸的体积为200 mL ,物质的量浓度为1.5 mol·L-1,当电解池中某碳棒上产生3.36 L(标准状况)气体时,求:
①有 个电子通过了电线(NA=6.02×1023)。
②此时原电池溶液中H+的物质的量浓度为 mol/L(不考虑溶液体积变化)。
按图所示实验过程填空:
(1)写出上述反应的离子方程式:
①②③
(2)填空:
ab cd