观察下列A、B、C、D、E五种粒子(原子或离子)的结构示意图,回答有关问题: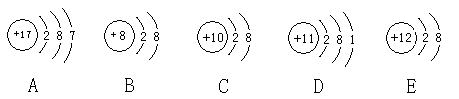
(1)属于离子结构示意图的是 、 (填写微粒符号)。
(2)五种粒子中,性质最稳定的原子是 (用微粒符号填写,在本小题中下同),最容易失去电子的原子是 ,最容易得到电子的原子是 。
(3)A、E两种元素形成的化合物在水溶液中的电离方程式是 。
(4)在核电荷数为1-18的元素中,写出两种与B核外电子层排布相同的离子,其离子的符号为 、 (A-E中已出现的元素除外)。
(5)在一定条件下,D可以和氮气(N2)化合成一种白色物质,该物质的化学式是 。
实验证明铜在低温下不能和O2发生反应,也不能和稀硫酸共热发生反应,但工业上却是将废铜屑倒入热的稀硫酸中并不断地通入空气来制取CuSO4溶液的。铜屑在此状态下发生的一系列反应的化学方程式为:________________________________________________________________________
________________________________________________________________________。
利用铜与浓硫酸在加热条件下也能制备CuSO4溶液,其化学方程式为________________________________________________________________________。
以上两种方法前者好还是后者好?原因是什么?________________________________________________________________________
________________________________________________________________________。
由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱溶液反应制得Fe(OH)2白色沉淀。若用左图所示实验装置,则可制得纯净的Fe(OH)2白色沉淀。已知两极材料分别为石墨和铁: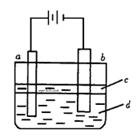
(1)a极材料为,电极反应式为。
(2)电解液d可以是,则白色沉淀在电极上生成;电解液d也可
以是,则白色沉淀在两极间的溶液中生成。
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液
(3)液体c为苯,其作用是,在加苯之前对d溶液
进行加热煮沸处理,目的是。
(4)为了在短时间内看到白色沉淀,可以采取的措施是。
A.改用H2SO4作电解液 B.适当增大电源电压
C.适当缩小两极间距离 D.适当地降低电解液的温度
(5)若d改为Na2SO4溶液,当电解一段时间,看到白色沉淀后,再反接电源继续电解,除了电极上看到的气泡外,另一明显的现象为。
现有下列仪器:①铁架台(含铁夹、铁圈)②锥形瓶③酸式滴定管和碱式滴定管
④烧杯⑤玻璃棒⑥胶头滴管 ⑦天平 ⑧滤纸⑨量筒⑩ 漏斗,请回答:
(1)过滤时应选用的仪器是__(填编号)
(2)配制一定物质的量浓度的NaOH溶液时,还缺少的仪器是__
(3)进行中和滴定时,不需用将要盛的溶液事先润洗的是__(填编号)
| A.酸式滴定管 | B.碱式滴定管 | C.25ml量筒 | D.锥形瓶 |
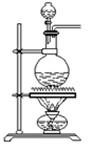
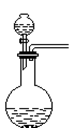
A、B、C是中学常见的几种实验装置图
| A |
B |
C |
 |
 |
 |
(1)在A、B、C下面的空格里分别填上能进行实验的序号
①酒精和浓硫酸混合加热制乙烯
②浓盐酸和二氧化锰加热制氯气
③分离苯和硝基苯的混合物
④用浓硝酸和铜反应制二氧化氮
⑤用电石和水反应制乙炔
⑥分离乙酸和乙醇的混合物
⑦从溴水中用苯提取溴单质
⑧浓硫酸与亚硫酸钠制二氧化硫
(2)上述装置中都使用了分液漏斗,其中真正起到分液作用的是_(填A、B、C)
(3)用B制取少量气体时,烧瓶可用___代替(填一仪器名称)
(4)若用B制备氧气,分液漏斗中盛放试剂为__,烧瓶中盛放试剂为__
指出使用下列仪器(已洗净)的第一步操作:
①容量瓶
②酸式滴定管
③集气瓶(集HCl)