复分解反应和氧化还原反应都是重要的反应类型。回答下列问题:
(1)“盐+酸—→新盐+新酸”是复分解反应中的一种类型。在Na2SiO3溶液中滴入盐酸,生成的新酸是 (写化学式)。
(2)硫化铝投入水中发生反应:Al2S3+6H2O====2Al(OH)3↓+3H2S↑,该反应 (填“属于”或“不属于”)复分解反应。
(3)Ca(HCO3)2与Ca(OH)2反应属于复分解反应,写出反应的化学方程式
;
(4)工业上可用氨与Cl2反应检验输送氯气的管道是否漏气,反应方程式如下:
8NH3+3Cl2====6NH4Cl+N2。
①请在上述方程式中表示出电子转移的方向和数目。
②该反应中,___ _____ __是还原剂;若反应中有1.5mol氧化剂参与反应,则发生转移的电子的物质的量为______ _mol,被氧化的物质有 mol。
_____ __是还原剂;若反应中有1.5mol氧化剂参与反应,则发生转移的电子的物质的量为______ _mol,被氧化的物质有 mol。
(5)若将Cl2通入KI溶液中会发现无色溶液变成棕黄色后又褪色。这 是因为发生如下2个反应:
是因为发生如下2个反应:
① ;
②I2+Cl2+H2O=====HIO3+ (不必配平)。
某厂废水中含5.00×10-3mol·L-1的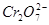 ,其毒性较大。某研究性学习小组为了变
,其毒性较大。某研究性学习小组为了变
废为宝,将废水处理得到磁性材料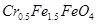 (
(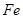 的化合价依次为+3、+2),设计了如下实验流程:
的化合价依次为+3、+2),设计了如下实验流程:


 (1)第①步反应的离子方程式是,
(1)第①步反应的离子方程式是,
(2)第②步中用PH试纸测定溶液PH的操作方法是:
,
(3)第③步过滤得到的滤渣中主要成分除Cr(OH)3外,还有,
(4)欲使1L该废水中的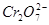 完全转化为
完全转化为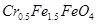 。理论上需要加入
。理论上需要加入
克FeSO4·7H2O。
在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸(以下填空分别用a、b、c表示)
(1)当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是。
(2)同体积、同物质的量浓度的三种酸,中和NaOH的能力由大到小的顺序是。
(3) 将c(H+)相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是。
(4)当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是。
(5)当c(H+)相同、体积相同时,同时加入形状、密度、质量完全相同的锌,则开始时反应速率的大小关系为。
在密闭容器中,保持一定温度进行如下反应N2(g)+ 3H2(g) 2NH3(g),已知加入1 mol N2和3 mol H2,在恒压条件下达到平衡时生成a mol NH3,在恒容条件下达到平衡时生成b mol NH3(见下表中编号①的一行)。若相同条件下,达到平衡时混合物中各组分的百分含量不变。回答下列问题:
2NH3(g),已知加入1 mol N2和3 mol H2,在恒压条件下达到平衡时生成a mol NH3,在恒容条件下达到平衡时生成b mol NH3(见下表中编号①的一行)。若相同条件下,达到平衡时混合物中各组分的百分含量不变。回答下列问题:
(1)写出该反应的化学平衡常数表达式:K=。
(2)平衡常数K值越大,表明建立平衡时(填字母序号)。
| A.N2的转化率越高 | B.NH3的产量越大 |
| C.正反应进行得越彻底 | D.化学反应速度越快 |
(3)a与b的关系是:ab(填>、<、=)
(4)填写下表空格:
| 状态 条件 |
起始时物质的物质的量(mol) |
平衡时NH3的物质的量 (mol) |
|||
| 编号 |
X(N2) |
Y(H2) |
Z(NH3) |
||
| 恒容 |
① |
1 |
3 |
0 |
b |
| ② |
0 |
0 |
b |
||
| ③ |
2.25 |
b |
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:
C(s)+H2O(g)  CO(g)+H2(g) ΔH=+131.3 kJ•mol-1,ΔS=+133.7J•(K•mol) -1
CO(g)+H2(g) ΔH=+131.3 kJ•mol-1,ΔS=+133.7J•(K•mol) -1
①该反应能否自发进行与有很大关系;
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是(填字母,下同)。
a.容器中的压强不变b.1 mol H—H键断裂的同时断裂2 molH—O键
c.v正(CO) = v逆(H2O) d.c(CO)=c(H2)
(2)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生如下反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ,
CH3OH(g)+H2O(g) ,
右图表示该反应进行过程中能量(单位为kJ•mol-1)的变化。
在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,
下列措施中能使c (CH3OH)增大的是。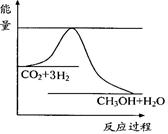
a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1mol CO2和3mol H2
以标准的盐酸滴定未知浓度的氢氧化钠为例,判断以下操作所引起的误差(填“偏大”“偏小”或“不变”)。
(1)读数:滴定前俯视或滴定后仰视()
(2)未用标准液润洗酸式滴定管()
(3)用待测液润洗锥形瓶()
(4)滴定前滴定管尖嘴有气泡,滴定后尖嘴气泡消失()
(5)移液管吸取待测液后,悬空放入锥形瓶,少量待测液洒在瓶外()
(6)碱式滴定管(量待测液用)或移液管用蒸馏水洗净后直接注入待测液()
(7)滴定过程中,锥形瓶振荡太剧烈,有少量液滴溅出()
(8)开始时标准液在滴定管刻度线以上,未予调整()
(9)锥形瓶用蒸馏水冲洗后,不经干燥便直接盛待测溶液()
(10)滴定接近终点时,用少量蒸馏水冲洗锥形瓶内壁()