铅蓄电池是化学电源,其电极材料分别是Pb和PbO2,电解质溶液为稀硫酸。工作时,该电 池的总反应为PbO2+P
池的总反应为PbO2+P b+2H2SO4=2PbSO4+2H2O根据上述情况判断
b+2H2SO4=2PbSO4+2H2O根据上述情况判断
(1)蓄电池的负极是___ ___,其电极反应式为___ ___。
___,其电极反应式为___ ___。
(2)蓄电池的正极是______,其电极反应式为__ ____。
(3)蓄电池工作时,其中电解质溶液的pH______(增大、减小、不变)。
(14分)下面是18×7的格子,按要求作答。
| A |
He |
||||||||||||||||
| C |
D |
||||||||||||||||
| E |
F |
H |
|||||||||||||||
(1)用封闭的实线绘出元素周期表的轮廓。注意:不得使用铅笔作图。(3分)
(2)“大爆炸理论”指出:200亿年以前,宇宙中所有物质都包含在一个密度无限大,温度无限高的原始核中,由于某种原因它发生了爆炸,首先产生了中子、质子和电子,随后就产生了元素。你由此可知最先产生的元素是_______(填写元素名称)(1分),其中子数比质子数多1的核素的原子符号是_________;(1分)
(3)C、D、E、F的简单离子半径由小到大顺序是_______________________(填写离子符号);(2分)
(4)请用电子式表示出E和H形成的化合物形成过程:_____________________________;(2分)
(5)用实线绘出金属与非金属的分界线。注意:不得使用铅笔作图。(2分)
(6)用来组成酸、碱、盐三类物质至少需要的元素有__________(填写表中字母)。(3分)
A、B、C三种强电解质,它们溶于水在水中电离出的阳离子有K+、Ag+,阴离子有NO3-、OH-(电解质电离的离子有重复)。
图1装置中,甲、乙、丙三个烧杯中依次盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为铂电极。接通电源,经过一段时间后,测得甲中b电极质量增加了43.2g。常温下各烧杯中溶液pH与电解时间t关系如图2。请回答下列问题: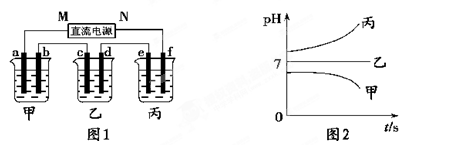
(1)写出三种强电解质的化学式:A;B;C。
(2)写出乙烧杯c电极发生的电极反应为__________________________,甲烧杯中的总反应的化学方程式为___________________________________________。
(3)计算丙烧杯e电极上生成的气体在标准状况下的体积为________________,甲烧杯中溶液的pH=。(假设溶液体积是400ml)
(4)要使甲烧杯中的A溶液恢复到电解前的状态,需要加入的物质是_____________,其质量为。
(5)若直流电源使用的是铅蓄电池,铅蓄电池的正极材料是PbO2,负极材料是Pb,电解质溶液时H2SO4,则放电时N级上发生的电极反应为________________________________
____________________,M级附近溶液的pH(选填“升高”或“降低”或“不变”)。
铅蓄电池充电时,若阳极和阴极之间用阳离子交换膜(只允许H+通过)隔开,则当外电路通过0.2mol电子时,由阳极室通过阳离子交换膜进入阴极室的阳离子有mol。
工业上制氯化铜无水物时,是将浓盐酸用蒸气加热至80 ℃左右,慢慢加入粗制氧化铜粉(含杂质氧化亚铁和SiO2),充分搅拌后使之溶解,制取流程如下: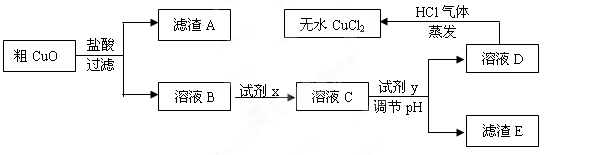 已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;常温时Ksp[Fe(OH)3]=c(Fe3+).c3(OH-)=1.0×10-38。试回答:
已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;常温时Ksp[Fe(OH)3]=c(Fe3+).c3(OH-)=1.0×10-38。试回答:
(1)根据常温时Fe(OH)3的Ksp计算,当溶液中的Fe3+完全沉淀(此时溶液中的Fe3+物质的量的浓度=10-5mol/L),溶液的pH=。
(2)溶液D制取无水CuCl2时,需在HCl气体中蒸干,原因是
。
(3)粗CuO溶于过量盐酸后,得到的溶液B中加入试剂x将Fe2+氧化为Fe3+,试剂x可以是(填以下选项序号)。
A.KMnO4溶液 B.氯水 C.NaClO溶液 D.O3
若用H2O2溶液,则反应的离子方程式为。
(4)溶液C加入试剂y,要调整溶液的pH至3-4,试剂y不能是(填以下选项序号),原因是。
A.NaOH溶液 B.Cu(OH)2固体 C.Cu2(OH)2CO3固体 D.CuO固体
(5)将ag粗CuO经过以上一系列操作之后,最终得到bg无水CuCl2(不考虑实验过程中操作引起的损耗),下列说法正确的是。(NA表示阿伏伽德罗常数)
A.粗CuO中Cu2+数目小于
B.粗CuO中CuO物质的量小于 mol
mol
C.粗CuO中所含的铜元素的质量分数为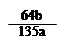 ×100℅
×100℅
D.粗CuO中关于CuO的量无法确定
常温,向浓度为0.1mol/L,体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应。根据图像回答下列问题: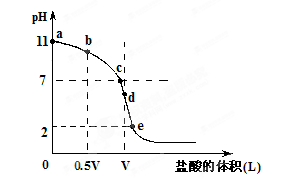
(1)氨水的电离方程式为,该温度时氨水的电离平衡常数K=。
(2)比较b、c、d三点时的溶液中,水电离的c(OH-)大小顺序为。
(3)滴定时,由b点到c点的过程中,下列各选项中数值保持不变的有。
(4)根据以上滴定曲线判断下列说法正确的是(溶液中N元素只存在NH4+和NH3.H2O两种形式)。
| A.点b所示溶液中:c(NH4+)+c(H+)=c(NH3.H2O)+c(OH-) |
| B.点c所示溶液中:c(Cl-)=c(NH3.H2O)+c(NH4+) |
| C.点d所示溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
| D.滴定中可能有:c(NH3.H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+) |
(5)滴定过程中所用盐酸的pH=,d点之后若继续加入盐酸至图像中的e点(此时不考虑NH4+水解的影响),则e点对应的横坐标为。
在体积为1L的两个恒容密闭容器中,分别充入1molCO和1molH2O(g)的混合气体,进行如下化学反应:CO(g)+H2O(g)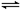 CO2(g)+H2(g),反应物CO的物质的量在不同温度时物质的量随时间的变化如下表所示,回答下列问题:
CO2(g)+H2(g),反应物CO的物质的量在不同温度时物质的量随时间的变化如下表所示,回答下列问题:
| 0min |
10min |
20min |
30min |
40min |
50min |
|
| 830℃ |
1mol |
0.8mol |
0.65mol |
0.55mol |
0.5mol |
0.5mol |
| 1100℃ |
1mol |
0.75mol |
0.6mol |
0.6mol |
0.6mol |
0.6mol |
(1)1100℃时,前10min该反应的化学反应速率v(CO2)=,830℃平衡后CO转化率的为__________________。
(2)1100℃时化学平衡常数K=_______,该反应为________反应(填“吸热”和“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是____________________。
(a)容器中压强不变 (b)混合气体中c(CO)不变
(c)v逆(H2)=v正(H2O) (d)c(CO2)=c(CO)
(4)1100℃时达到平衡后,若向容器中再充入2molCO和2molH2O(g),平衡_____________________移动(选填“向正反应方向”或“向逆反应方向”或“不”),再达到平衡时,H2百分含量________________(选填“增大”或“减小”或“不变”)。
(5)830℃时,若在体积为2L的密闭容器中充入1molCO2和1molH2的混合气体,60min时反应达平衡状态,画出c(CO)和c(H2)随时间变化而变化的趋势图。