铅蓄电池是典型的可充型电池,它的正负极板是惰性材料,电池总反应式为:
请回答下列问题(不考虑氢、氧的氧化还原):
(1)放电时:正极的电极反应式是___________________________;电解质溶液中H2SO4的浓度将_______ (填“变大”、“变小”或“不变”);当外电路通过1 mol电子时,理论上负极板的质量增加_______ g。
(2)在完全放电耗尽PbO2和Pb时,若按图连接,电解一段时间后,则在A电极上生成____________、B电极上生成______________,此时铅蓄电池的正负极的极性将_______________________。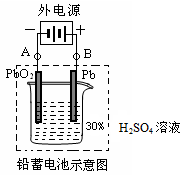
下列物质:①O2 ②三氯甲烷 ③CH3CH2CH2OH ④O3 ⑤CHCl3 ⑥CH3OCH2CH3
⑦C ⑧CH3CH(OH)CH3 ⑨C ⑩CH3OH。其中属于同系物的有________(填序号,下同),互为同分异构体的有________,互为同素异形体的有________,属于同位素的有________,是同一种物质的有________。
丙酸盐是安全有效的防霉、防腐剂,一种以碱式碳酸锌为原料的工艺流程如下: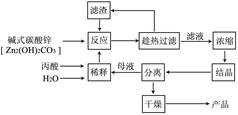
| 序号 |
n(丙酸)∶n(碱式碳锌) |
反应温度/℃ |
丙酸锌产率/% |
| 1 |
1∶0.25 |
60 |
67.2 |
| 2 |
1∶0.25 |
80 |
83.5 |
| 3 |
1∶0.25 |
100 |
81.4 |
| 4 |
1∶0.31 |
60 |
89.2 |
| 5 |
1∶0.31 |
80 |
90.1 |
| 6 |
1∶0.31 |
100 |
88.8 |
(1)探究本实验中最佳工艺条件(见上表):反应时间2h,用水量45g,n(丙酸)∶n(碱式碳酸锌)=1∶ ,反应温度 ℃。
(2)某次实验时,将37.0g丙酸溶于220mL水中,按上述流程在上述优化的条件下制备,最终得产品丙酸锌49.6g,则该次实验丙酸锌的产率为 。
(3)本工艺采用“闭路循环”方式,除具有制备工艺简便、产率高外,还具有 的优点。
工业上用铝土矿(成分为氧化铝、氧化铁)制取铝的流程如下: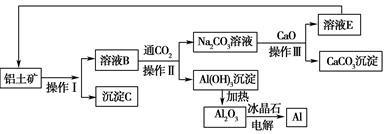
请回答下列问题:
(1)操作Ⅰ、操作Ⅱ、操作Ⅲ都用到的玻璃仪器有________。
(2)写出由溶液B生成Al(OH)3的离子方程式:__________________________。
(3)工艺流程中涉及氧化还原反应的化学方程式为_____________________。
(4)生产过程中,除NaOH、H2O可以循环使用外,还可以循环使用的物质有________(填化学式)。用此法制取铝的副产品是________(填化学式)。
A、B、C、D、E均为有机化合物,它们之间的关系如下图所示(提示:RCH===CHR′在酸性高锰酸钾溶液中反应生成RCOOH和R′COOH,其中R和R′为烷基)。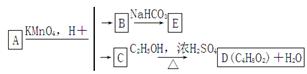
回答下列问题:
(1)直链化合物A的相对分子质量小于90,A分子中碳、氢元素的总质量分数为0.814,其余为氧元素,则A的分子式为__________;
(2)已知B与NaHCO3溶液完全反应,其物质的量之比为12,则在浓硫酸的催化下,B与足量的C2H5OH发生反应的化学方程式是__________,反应类型为:__________;
(3)A可以与金属钠作用放出氢气,能使溴的四氯化碳溶液褪色,则A的结构简式是__________;
(4)D的同分异构体中,能与NaHCO3溶液反应放出CO2的有__________种,其相应的结构简式是__________。
【试题出处】2012-2013福州一中模拟
在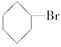 与NaOH的醇溶液共热一段时间后,要证明
与NaOH的醇溶液共热一段时间后,要证明 已发生反应,甲、乙、丙三名学生分别选用了不同的试剂和方法,都达到了预期的目的,请写出这三组不同的试剂名称和每种试剂的作用.
已发生反应,甲、乙、丙三名学生分别选用了不同的试剂和方法,都达到了预期的目的,请写出这三组不同的试剂名称和每种试剂的作用.
第一组试剂名称________,作用__________________;
第二组试剂名称________,作用__________________;
第三组试剂名称________,作用__________________.