(二)(14分)下图所涉及的物质均为中学化学中的常见物质,其中C为O2、D为C12、E为Fe单质,其余为化合物。它们存在如下转化关系,反应中生成的水及次要产物均已略去。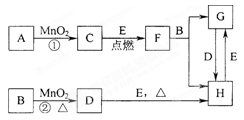
(1)写出有关物质的名称或化学式:B ,F ,H 。
(2)指出MnO2在相关反应中的作用:反应①中是 剂,反应②中是 剂。
(3)若反应①是在加热条件下进行,则A是 ;若反应①是在常温条件下进行,则A是 。
(4)写出B与MnO2共热获得D的化学方程式 。
(5)H的溶液呈 (酸性、碱性)原因: 。
(6)检验H溶液中阳离子的操作是:-------------
工业上用铝土矿(主要成分SiO2、Al2O3、Fe3O4)提取氧化铝作冶炼铝的原料,提取的操作过程如下图所示:
(1)不溶物为___________(写化学式,下同),滤液甲中的溶质为______________________;
(2)滤液甲中含铝元素的溶质与过量NaOH溶液反应进入滤液乙,发生此反应的反应物的物质的量之比为_____________。若使用氨水能否达到上述目的__________(填“能”或“否”)。
(3)若向滤液甲中加入碘化钾溶液,相关的离子反应方程式为______________________,从该溶液中获得碘单质需要加入____________(填试剂名称),振荡、静置,再经______________(填操作名称),蒸馏后即得到碘单质。
(4)③步骤中通入二氧化碳是过量的,写出此步发生的离子反应方程式:_____________________;
(5)若将铝土矿用过量氢氧化钠溶液溶解,过滤后向滤液中通入过量CO2,再经过滤、加热得到的物质是______________________。
(6)②步骤得到的沉淀为灰绿色,沉淀变为红褐色需要较长时间,欲快速得到红褐色沉淀,可以向此沉淀中加入过量的_________(填字母)
| A.过氧化钠 | B.氯水 | C.稀硝酸 | D.酸性高锰酸钾溶液 |
为确定SO2、CO2、Cl2的混合气体的各种成分,小龙同学做了如下探究。
(1)三种气体都具有的性质是___________(填字母);
A.漂白性和氧化性 B.水溶液显酸性 C.能与碳酸钠溶液反应 D.能与非金属单质反应
(2)通过观察颜色,可以确定混合气体中含有_________,为了检验另两种气体,可以将混合气体通过下列试剂中的_____________________(填字母)洗去该气体;
A.氢氧化钠溶液 B.饱和食盐水 C.硫化氢溶液 D.四氯化碳
(3)确定另外两种气体的成分时,需要依次通过A、B、C、D四个洗气瓶:
A.品红溶液 B.酸性高锰酸钾溶液 C.品红溶液 D.澄清石灰水
①能说明混合气体中含有CO2的实验现象是_______________________________;
②B中溶液紫红色褪去产生Mn2+和SO42-写出此反应的离子反应方程式_______________________。
危化仓库中往往存有钠、钾、硫、白磷(P4)、硝酸铵和氰化钠(NaCN)等危险品。请回答下列问题:
(1)NH4NO3为爆炸物,在某温度下按下式进行分解:5NH4NO3 =4N2 ↑+ 2HNO3 + 9H2O
则被氧化和被还原的氮元素质量之比为_____________;
(2)硫酸铜溶液是白磷引起中毒的一种解毒剂:1lP4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4
若6molH3PO4生成,则被CuSO4氧化的P4的物质的量为______________mol;
(3)NaCN属于剧毒物质,有一种处理方法其原理为:CN-与S2O32-反应生成两种离子,一种与Fe3+可生成红色弱电解质,另一种与H+作用产生能使品红溶液腿色的刺激性气体,写出离子反应方程式:_________________________________。
用化学方程式解释下列问题
(1)久置氯水不能使有色布条褪色:_____________________________;
(2)被SO2漂白的品红溶液中通入氯气后先复色再褪色,解释“复色”的原因:______________;
(3)氢氟酸不能用玻璃瓶储存:_________________________________;
(4)饱和亚硫酸钠溶液能吸收SO2________________________________;
(5)氯化铁溶液能吸收硫化氢___________________________________。
(1)工业上常用 CO2和 NH3通过如下反应合成尿素[CO(NH2)2]。
2NH3(g)+CO2(g)  CO(NH2)2(g)+H2O(g) △H<0
CO(NH2)2(g)+H2O(g) △H<0
t℃时,向容积恒定为 2L的密闭容器中加入 0.10 molCO2和 0.40 molNH3, 70 min 开始达到平衡。反应中 CO2 (g)的物质的量随时间变化如下表所示:
| 时间/min |
0 |
20 |
70 |
80 |
100 |
| n(CO2)/mol |
0.10 |
0.060 |
0.020 |
0.020 |
0.020 |
①70 min 时,平均反应速率 υ(CO2)= mol/(L·min)。
②在100 min时,保持其它条件不变,再向容器中充入0.050 mo1CO2和0.20 molNH3, 重新建立平衡后CO2的转化率与原平衡相比将___________(填“增大”、“不变”或“减小”)。
③上述可逆反应的平衡常数为_________(保留一位小数)。
④下图所示装置(阴、阳极均为惰性电极)可用于电解尿素〔CO(NH2)2〕的碱性溶液 制取氢气。该装置中阳极的电极反应式为__________________。
(2)CH4燃料电池,装置示意如图(A、B为多孔性碳棒)。
持续通入甲烷,在标准状况下,消耗甲烷体积VL。当0<V≤44.8 L 时,电池总反应方程式为______________。