铝和氢氧化钠都是重要的工业产品。请回答:
(1)工业冶炼铝的化学方程式是 ________________ 。
(2)可用阳离子交换膜法电解饱和食盐水制NaOH,其工作原理如左下图所示。
①请写出A、B两处物质的名称:A___________________、 B____________________
B____________________
②请写出电解食盐水的离子方程式__________________________________________
(3)以镁条、铝片为电极,以NaOH溶液为电解质溶液设计的原电池如上中图。
①负极材料为________(填Mg或Al)。
②该原电池的总反应式为____________________________________________
(要求用单线桥标出电子转移的方向和数目)
(4)铝—空气燃料电池可用于电动汽车,通常以NaOH溶液为电解液,铝合金为负极,通入空气的极为正极(如右上图),则
负极的电极反应式为 ______________________ ;
正极的电极反应式为_______________ ____________________。
____________________。
“洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了热值高达122500~16000 kJ·m-3的煤炭气,其主要成分是CO和H2。CO和H2可作为能源和化工原料,应用十分广泛。
(1)已知:C(s)+O2(g)=CO2(g) ΔH1=—393.5 kJ·mol-1①
2H2(g)+O2(g)=2H2O(g) ΔH2=—483.6 kJ·mol-1②
C(s)+H2O(g)=CO(g)+H2(g) ΔH3=+131.3 kJ·mol-1③
则反应CO(g)+H2(g) +O2(g)= H2O(g)+CO2(g),ΔH= kJ·mol-1。标准状况下的煤炭气(CO、H2)33.6 L与氧气完全反应生成CO2和H2O,反应过程中转移mol e-。
(2)密闭容器中充有10 mol CO与20 mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g) 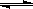 CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如图所示。
CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如图所示。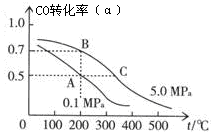
①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为VAL,则该温度下的平衡常数K=;A、B两点时容器中物质的物质的量之比为n(A)总:n(B)总=。
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tAtC(填“大于”、“小于”或“等于”)。
③在不改变反应物用量的情况下,为提高CO的转化率可采取的措施是。
A.降温 B.加压 C.使用催化剂 D.将甲醇从混合体系中分离出来
X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(写元素符号)。
(2)由以上某些元素组成的化合物A、B、C、D有如下转化关系: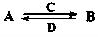 (在水溶液中进行)其中,C是溶于水显酸性的气体;D是淡黄色固体。写出C的结构式:;D的电子式:。
(在水溶液中进行)其中,C是溶于水显酸性的气体;D是淡黄色固体。写出C的结构式:;D的电子式:。
①如果A、B均由三种元素组成,B为两性不溶物,则A的化学式为;由A转化为B的离子方程式为。
②如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性。用离子方程式表示A溶液显碱性的原因:。常温下,A、B浓度均为0.1mol·L-1的混合溶液中,在该溶液中滴加稀盐酸至中性时,溶质的主要成分有。
化学计量在化学中占有重要地位,请回答下列问题:
(1)标准状况下6.72 L NH3分子中所含原子数与mL H2O所含原子数相等。
(2)已知16 g A和20 g B恰好完全反应生成0.04 mol C和31.76 g D,则C的摩尔质量为。
(3)把V L含有MgSO4与K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为Mg(OH)2;另一份加入含b mol BaCl2的溶液,恰好使SO42-完全沉淀为BaSO4,则原混合溶液中钾离子的物质的量浓度为________。(用a、b、V表示)
铁是重要的常见金属材料,也是人类较早使用的金属之一。请运用铁及其化合物的知识,完成下列问题。
(1)铁路大提速后,为将短铁轨焊接成长铁轨,可在铁轨接口处加入四氧化三铁和铝粉的混合物,用镁条引燃发生反应,写出发生置换反应的化学方程式并用单线桥法标出电子转移__________________;
(2)向20mL的沸蒸馏水中逐滴滴加5~6滴0.1mol/L的FeCl3溶液,继续煮沸没有观察到透明的红褐色现象,请问此时分散系中粒子直径的范围是______nm,判断的依据是_________________________;
(3)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:_________________________。
(4)某校同学为测定FeCl3腐蚀铜后所得溶液的组成,提出如下假设:
a.只含________________________(填写溶质化学式)。
b.可能组成为___________________(填写溶质化学式)。
(5)欲从废腐蚀液中回收铜,并重新获得FeCl3溶液,设计实验方案如下: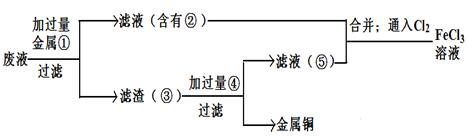
请写出上述实验中加入或生成的有关物质的化学式:
①__________ ③_____________④___________
过氧化氢(H2O2,O的化合价为-1价)俗称双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。研究下列涉及H2O2的反应,完成下列各题:
A.Ag2O+ H2O2=2Ag+O2 ↑+ H2O
B.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
(1)写出一个H2O2既体现氧化性又体现还原性的化学反应方程式。
(2)将下列物质:H2O2、K2SO4、MnSO4、H2SO4、KMnO4、O2的化学式分别填在空白处组成一个不需配平的化学方程式:+ +______ →+ + + H2O
①该反应中的还原剂是。
②该反应中,发生还原反应的元素是。
(3)氧化性:KMnO4_____K2CrO4(填“>”或“<”)。