(1)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。把与下面元素有关的性质相符的曲线标号填入相应的空格中: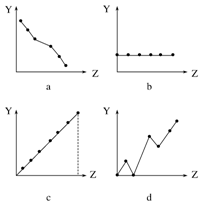
①ⅡA族元素的价电子数 。
②第三周期元素的最高化合价 。
③F-、Na+、Mg2+、Al3+的离子半径 。
(2)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y元素原子最外层电子数与核外电子总数之比为3∶4;M元素原子的最外层电子数与电子层数之比为4∶3;N-、Z+、X+的半径逐渐减小;化合物XN常温下为气体。据此回答:
①N的最高价氧化物对应的水化物的化学式为 。
②X、Y、Z元素符号分别为:X 、Y 、Z 。
③工业上制取单质M的化学方程式为_____________________________ 。
二氧化钛是钛的重要化合物,是一种白色颜料。工业上常用硫酸法从钛铁矿(主要成分FeTiO3,含Fe2O3、SiO2等杂质)制取二氧化钛,其流程如下: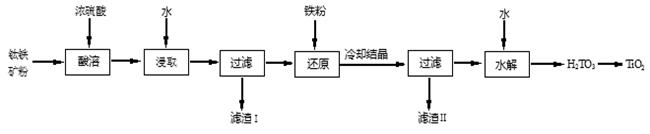
(1)流程中把钛铁矿石粉碎为钛铁矿粉的目的是 。
(2)钛铁矿主要成分与浓硫酸反应的主要产物是TiOSO4和FeSO4,该反应的化学方程式为 ;酸溶过程中浓硫酸过量除了使钛铁矿充分反应外还因为 。
(3)浸取液与铁屑反应的离子方程式为 ;滤渣Ⅱ主要成分的化学式为 。
(4)水解前溶液中存在TiO2+、SO42-等水解反应离子方程式为 。
由某金属的混合物(含65%Cu、25%Al、8%Fe及少量Au、Pt)制备硫酸铜和硫酸铝晶体的路线设计如下: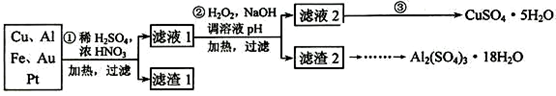
已知:物质开始沉淀和沉淀完全的pH数值表如下: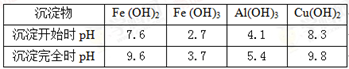
请回答下列问题:
(1)第①步Cu与酸反应的离子方程式为
得到滤渣1的主要成分为
(2)第②步加H2O2的作用是(用离子反应方程式表示)
调溶液pH使之达到:5.4≤pH <8.3 的目的是
(3)由第③步得到CuSO4·5H2O晶体的步骤是将滤液2 、 再过滤、洗涤、干燥。
(4)现由洗涤后的滤渣2制取Al2(SO4)3·18H2O ,请你在横线上将下列流程图补充完整。(要求标明每步所用试剂和主要操作步骤)
聚芳酯(PAR)是分子主链上带有苯环和酯基的特种工程塑料,在航空航天等领域具有广泛应用。下图是利用乙酰丙酸( )合成聚芳酯E的路线:
)合成聚芳酯E的路线: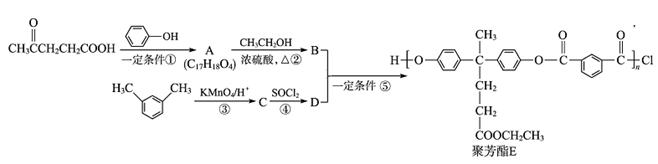
已知:①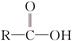 +SOCl2→
+SOCl2→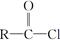 +SO2+HCl
+SO2+HCl
②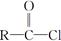 +R′OH→
+R′OH→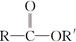 +HCl
+HCl
(R、R′表示烃基)
(1)乙酰丙酸中含有的官能团是羰基和__________(填官能团名称)。
(2)下列关于有机物A的说法正确的是______________(填字母序号)。
a.能发生加聚反应b.能与浓溴水反应
c.能发生消去反应d.能与H2发生加成反应
(3)A→B的化学方程式为________________________。
(4)D的结构简式为________________________。
(5)C的分子式为____________,符合下列条件的C的同分异构体有________种。
①能发生银镜反应
②能与NaHCO3溶液反应
③分子中有苯环,无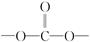 结构
结构
在上述同分异构体中,有一类有机物分子中苯环上只有2个取代基,写出其中任一种与足量NaOH溶液共热反应的化学方程式:________________________。
化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行以下探究:
查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其他成分遇到盐酸时无气体产生。
Ⅰ.摩擦剂中氢氧化铝的定性检验
取适量牙膏样品,加水充分搅拌、过滤。
(1)往滤渣中加入过量NaOH溶液,过滤。氢氧化铝与NaOH溶液反应的离子方程式是 。
(2)往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸。观察到的现象是 。
Ⅱ.牙膏样品中碳酸钙的定量测定
利用如图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。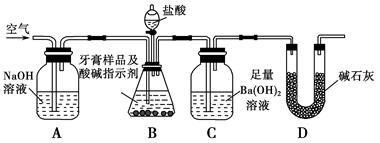
依据实验过程回答下列问题:
(3)实验过程中需持续缓缓通入空气。其作用除了可搅拌B、C中的反应物外,还有 。
(4)C中反应生成BaCO3的化学方程式是 。
(5)下列各项措施中,不能提高测定准确度的是 (填标号)。
a.在加入盐酸之前,应排净装置内的CO2气体
b.滴加盐酸不宜过快
c.在A~B之间增添盛有浓硫酸的洗气装置
d.在B~C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(6)实验中准确称取8.00 g样品三份,进行三次测定,测得BaCO3平均质量为3.94 g。则样品中碳酸钙的质量分数为 。
(7)有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,就可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是 。
【原创】(15分)已知X、Y、Z、Q、R、T都是元素周期表中前四周期的元素,它们的原子序数依次增大。X元素原子核外只有一个电子,Y元素的某种同位素可用于考古,Q2-和R+有相同的核外电子排布,短周期元素中R元素的原子半径最大,T 是第23号元素。
请回答下列问题。(注意:用正确的化学用语回答)
(1)Y、Z、Q三种元素的电负性由大到小的顺序是 。
(2)Q22+与Y22—互为等电子体,1 mol Q22+中含有的π键数目为 NA。
(3)在铜催化作用下,由氟气(F2)和过量的ZX3反应得ZF3,另一种产物为盐。则ZF3空间构型为 ,Z原子的杂化方式为 。该反应的化学方程式可表示为: 。
(4)化合物R2Q的晶胞如图。其中Q离子的配位数为 ,该化合物与MgO相比,熔点较高的是 。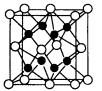
(5)3.0g Y2X6完全燃烧并恢复到常温,放出155.8KJ热量,写出表示Y2X6燃烧热的的热化学方程式
。
(6)基态T原子的价电子排布式为 。
某种由T元素形成的储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示。
①充电过程中,右槽溶液颜色变化为 。
②放电过程中正极的电极方程式为 。